メンバー
藤澤貴央(助教)、竹中哲(D2)、桃澤優里花(M2)
研究概要
亜鉛は多くのタンパク質の適切な立体構造形成や酵素活性に必要な必須微量元素です。生体内の亜鉛恒常性の異常は様々な疾患に繋がることが報告されており、亜鉛が生命活動の維持に重要な役割を担っていることに疑いの余地はありません。しかしながら、亜鉛の恒常性異常が疾患を引き起こす詳細な分子機構については未だ不明な点が多く、徹底的な基礎研究が必要とされています。我々のグループでは、細胞が亜鉛の恒常性異常に対して応答する分子メカニズムの解明を目指して研究を行っています。
研究内容①―SOD1構造変化のメカニズムと意義
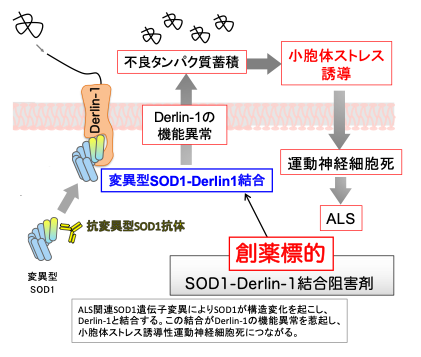
亜鉛配位タンパク質であるCu/Zn superoxide dismutase (SOD1)は、神経変性疾患である筋萎縮性側索硬化症(Amyotrophic Lateral Sclerosis; ALS)の原因として知られています。これまでに私達は、100種類を超えるALS関連変異型SOD1が毒性を発揮する共通の分子機構を明らかにしてきました。すなわち、様々な変異型SOD1が特異的に直接結合する標的タンパク質として、小胞体品質管理に重要な役割を担う小胞体膜貫通タンパク質Derlin-1を同定し、その結合が神経細胞の小胞体品質管理機構の破綻をきたし、運動神経細胞死を誘導することを発見しました[文献1]。また、その分子機構として、野生型SOD1においては立体構造上内部に隠されたDerlin-1との結合領域(Derlin-1 Binding Region; DBR)が露出することを明らかにしてきました[文献2]。どのようなSOD1遺伝子変異がSOD1タンパク質に構造変化を起こすのかについては、データベースとしてGitHub上での公開も行っています(https://github.com/TakaoFujisawa/SOD1_database)。最近、この分子機構に基づき、ALSモデルマウスの寿命延長効果のあるSOD1-Derlin-1結合阻害化合物の開発に成功しました[文献3]。現在、SOD1-Derlin-1結合阻害化合物のALS治療薬としての実用化に向けた展開を進めています。
また、私達は、SOD1がALS変異のみならず亜鉛欠乏条件下でも「変異型様」に構造変化することを報告してきました[文献4]。しかしながら、定常状態におけるSOD1の立体構造維持の機構や、亜鉛欠乏条件下においてSOD1の構造変化が起こるメカニズムはわかっておらず、構造変化した変異型様SOD1の機能自体ほとんど明らかとなっていません。そこで、現在、「変異型様SOD1」をSOD1の新たな形態として捉え、その細胞内局在・結合因子・翻訳後修飾・酵素活性に関する基礎研究を行うことにより、SOD1の構造変化のメカニズムとその生理的意義・病態生理学的意義を明らかにしたいと考えています。
1. Nishitoh, H. et al. ALS-linked mutant SOD1 induces ER stress- and ASK1-dependent motor neuron death by targeting Derlin-1. Genes Dev 22, 1451–1464 (2008).
2. Fujisawa, T. et al. A novel monoclonal antibody reveals a conformational alteration shared by amyotrophic lateral sclerosis-linked SOD1 mutants. Ann Neurol 72, 739–749 (2012).
3. Tsuburaya, N.et al. A small-molecule inhibitor of SOD1-Derlin-1 interaction ameliorates pathology in an ALS mouse model. Nat Commun 9, 2668 (2018).
4. Homma, K. et al. SOD1 as a molecular switch for initiating the homeostatic ER stress response under zinc deficiency. Mol Cell 52, 75–86 (2013).
研究内容②―亜鉛欠乏状況下における遺伝子発現変動の分子機構
生命活動に必須である亜鉛恒常性を保つため、細胞は亜鉛欠乏ストレスに対して転写レベルで応答する機構を備えています。古くから、亜鉛欠乏状況下でその活性を変化させるDNA結合性の転写因子を介した遺伝子発現制御機構が研究されてきました。しかしながら、亜鉛欠乏ストレスに対する転写応答機構の詳細については未だ不明な点が多く、特にヒストン修飾を介した遺伝子発現制御機構については全くわかっていません。亜鉛は必須微量元素として多くの生命現象に関与する重要な因子であるため、これは一見意外なことと思われますが、一方で、遺伝子発現制御機構の研究には高度なバイオインフォマティクス技術が必要となるため、未だ亜鉛研究者が遺伝子発現制御分野に入り込めていないのが実情でもあります。私達のグループでは、研究室で保有するバイオインフォマティクス専用の高機能Ubuntuマシンや、東京大学 医科学研究所 ヒトゲノム解析センターが保有するスーパーコンピューター SHIROKANEを利用したバイオインフォマティクス解析を精力的に行っています。これらのビッグデータ解析により得られた知見をもとに、亜鉛欠乏時の遺伝子発現変動の分子機構について、特にヒストン修飾や、ヒストンの修飾酵素「writer」、認識タンパク質「reader」、脱修飾酵素「eraser」に着目した研究を行っています。