2023年度 名黒グループ紹介
【メンバー】
名黒 功(准教授)、足立 浩輝(M2)
【研究概要】
名黒グループでは、細胞が常にさらされている浸透圧という物理環境に着目して、細胞による感知メカニズム、体内浸透圧環境の役割、病態との関わりについて焦点を当てて研究を行っています。浸透圧は水や塩といった身近な物質が作り出す環境因子ですが、細胞内の分子という視点から改めて捉え直すと、免疫、代謝、疾患を中心に、生体との興味深い関係性が浮かび上がってきます。
過剰な食塩の摂取は高血圧のリスクを増やすは広く知られていますが、他にも自己免疫疾患の増悪や認知機能の低下などとも関連することが報告されています1,2。また、マウスを用いた実験で、水分摂取の制限は、慢性炎症状態の悪化、老化の促進、寿命の短縮などを引き起こすという研究結果もあります3。このように普段の食生活と疾患や老化との関係は大変興味深いことですが、現在でも様々な仮説が検討されており、何故このようなことが起こるのか十分理解されていません。
当グループでは、水や塩が変化させる浸透圧環境という要素に着目し、我々が独自に発見した浸透圧応答性キナーゼASK3を中心として、浸透圧環境と生体との関わりをテーマに研究に取り組んでいます。
【研究内容】
▶︎哺乳類細胞の浸透圧応答機構 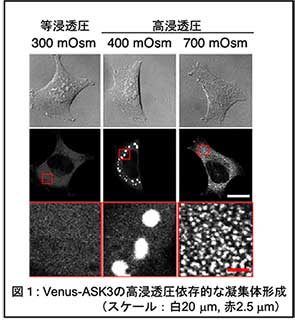 我々は、2012年に周囲の浸透圧変化に応じて細胞内でリン酸化活性を変化させるApoptosis Signal-regulating Kinase (ASK3)というキナーゼを報告しました4。このキナーゼの浸透圧応答はとても面白く、分単位の間に、低浸透圧で活性化、高浸透圧で逆に不活性化するという両方向性を示します。周囲の浸透圧の情報を細胞内のシグナル伝達に変換するために非常に適した分子として着目し、解析を進めています。ASK3の機能としては、浸透圧で変化した細胞体積の回復5や、腎臓におけるWNK-SPAK/OSR1経路の制御を介した血圧調節4に関わることを明らかにしています。さらに、独自のゲノムワイドsiRNAスクリーニングの結果に端を発する研究から、ASK3がどのように浸透圧でキナーゼ活性を変化させるのか少しずつ分子メカニズムがわかってきています6。ASK3は高浸透圧にさらされた細胞内で液-液相分離(LLPS)を引き起こし、可逆的な凝集体を形成します(図1)。凝集体形成できないASK3変異体は浸透圧応答性を失うことや、浸透圧の程度によって凝集体の大きさや数が変わることから、この凝集体形成が浸透圧の感知に重要な役割を担っているようです。現在は、この凝集体形成や性質の変化(大きさ、流動性など)に関わるメカニズムの解析からASK3の浸透圧応答機構を明らかにしようとしています。
我々は、2012年に周囲の浸透圧変化に応じて細胞内でリン酸化活性を変化させるApoptosis Signal-regulating Kinase (ASK3)というキナーゼを報告しました4。このキナーゼの浸透圧応答はとても面白く、分単位の間に、低浸透圧で活性化、高浸透圧で逆に不活性化するという両方向性を示します。周囲の浸透圧の情報を細胞内のシグナル伝達に変換するために非常に適した分子として着目し、解析を進めています。ASK3の機能としては、浸透圧で変化した細胞体積の回復5や、腎臓におけるWNK-SPAK/OSR1経路の制御を介した血圧調節4に関わることを明らかにしています。さらに、独自のゲノムワイドsiRNAスクリーニングの結果に端を発する研究から、ASK3がどのように浸透圧でキナーゼ活性を変化させるのか少しずつ分子メカニズムがわかってきています6。ASK3は高浸透圧にさらされた細胞内で液-液相分離(LLPS)を引き起こし、可逆的な凝集体を形成します(図1)。凝集体形成できないASK3変異体は浸透圧応答性を失うことや、浸透圧の程度によって凝集体の大きさや数が変わることから、この凝集体形成が浸透圧の感知に重要な役割を担っているようです。現在は、この凝集体形成や性質の変化(大きさ、流動性など)に関わるメカニズムの解析からASK3の浸透圧応答機構を明らかにしようとしています。
また、リン酸化シグナル伝達を担うASK3の他にも、浸透圧依存的な遺伝子発現を制御するNuclear Factor of Activated T cells 5 (NFAT5)という転写因子の解析や、リピドミクス、メタボロミクスを使った浸透圧依存的な細胞内代謝物の変化の解析も進めており、哺乳類細胞の浸透圧応答機構について、シグナル伝達・遺伝子発現・細胞代謝という多面的な切り口からアプローチしています。
▶︎生体内で浸透圧環境が制御する生理学(Osmo-physiology)の解析
近年まで、体内の浸透圧はどこでも約300 mOsmという等浸透圧に維持されており、例外としては積極的に水の輸送を行う腎臓などの臓器が、浸透圧勾配を能動的に作り利用している程度だと考えられていました。しかし、最近の論文により、脾臓や胸腺などのリンパ組織7や、感染部位8、がん組織9などの病変部位ではNa+が蓄積しており周囲より高浸透圧状態であると考えらえること、高食塩食で摂取した過剰なNa+が皮膚組織に蓄積する10ことなどが報告され、体内には局所や状況で異なる浸透圧環境が存在することが示唆されています。さらに、高Na+濃度にさらされたマクロファージやT細胞がより炎症促進性のサブセットに分化しやすくなること11,12が分かってきており、免疫システムとの関連性が注目されています。
我々の研究からも、浸透圧応答性をもつASK3が、既に報告した腎臓以外にも、脳の脈絡叢や、脾臓・腹腔のマクロファージなどで発現することが確認されており、これらの組織・細胞の機能における浸透圧環境の影響が想定されます。このようにASK3が発現する部位での浸透圧環境の影響を解析するとともに、生体内の浸透圧を細胞スケールでモニタリングできるプローブの開発を進め、体内浸透圧環境が関わる生理学(Osmo-physiology)についての理解を深めたいと考えています。特に、マクロファージなど免疫細胞と浸透圧環境の関連に焦点を当て、新たな観点から免疫システムの制御と炎症性疾患の理解・治療に貢献したいと考えています。
【参考文献】
1. Oh, Y. S. et al. National Heart, Lung, and Blood Institute Working Group Report on Salt in Human Health and Sickness: Building on the Current Scientific Evidence. Hypertension 68, 281–288 (2016).
2. Kleinewietfeld, M. et al. Sodium chloride drives autoimmune disease by the induction of pathogenic TH 17 cells. Nature 496, 518–522 (2013).
3. Allen, M. D., Springer, D. A., Burg, M. B., Boehm, M. & Dmitrieva, N. I. Suboptimal hydration remodels metabolism, promotes degenerative diseases, and shortens life. JCI Insight 4, (2019).
4. Naguro, I. et al. ASK3 responds to osmotic stress and regulates blood pressure by suppressing WNK1-SPAK/OSR1 signaling in the kidney. Nat. Commun. (2012).
5. Watanabe, K., Umeda, T., Niwa, K., Naguro, I. Ichijo, H. A PP6-ASK3 Module Coordinates the Bidirectional Cell Volume Regulation under Osmotic Stress. Cell Rep. (2018) .
6. Watanabe, K. et al. Cells recognize osmotic stress through liquid–liquid phase separation lubricated with poly(ADP-ribose). Nat. Commun. 12, 1–15 (2021).
7. Go, W. Y., Liu, X., Roti, M. A., Liu, F. Ho, S. N. NFAT5/TonEBP mutant mice define osmotic stress as a critical feature of the lymphoid microenvironment. Proc. Natl. Acad. Sci. U. S. A. 101, 10673–10678 (2004).
8. Jantsch, J. et al. Cutaneous Na+ storage strengthens the antimicrobial barrier function of the skin and boosts macrophage-driven host defense. Cell Metab. 21, 493–501 (2015).
9. Ouwerkerk, R. et al. Elevated tissue sodium concentration in malignant breast lesions detected with non-invasive 23Na MRI. Breast Cancer Res. Treat. 106, 151–160 (2007).
10. Machnik, A. et al. Macrophages regulate salt-dependent volume and blood pressure by a vascular endothelial growth factor-C-dependent buffering mechanism. Nat. Med. 15, 545–552 (2009).
11. Müller, D. N., Wilck, N., Haase, S., Kleinewietfeld, M. Linker, R. A. Sodium in the microenvironment regulates immune responses and tissue homeostasis. Nat. Rev. Immunol. 19, 243–254 (2019).
12. Wilck, N., Balogh, A., Markó, L., Bartolomaeus, H. Müller, D. N. The role of sodium in modulating immune cell function. Nat. Rev. Nephrol. 15, 546–558 (2019).
2016年度版
今年度は、珍しく新4年生が新しく名黒グループに配属されなかったのですが、大学院の修士1年として立野君が加わりました。一方で、昨年度は博士3年の神山さんが博士課程を、修士2年の花房君、町田君が修士課程を修了しました。神山さんは以前の服部君、渡邊君のように、修士1年の布施君を連れて現在新しいグループを作り、一條研で活躍しています(神山グループ参照)。修士の2人は、それぞれ就職し、社会人として新しいスタートを切っているはずです(既にラボに顔を見せにきてくれましたが)。こういうわけで、ここ2年2桁に達していた名黒グループはやや規模を縮小し、D3椎崎君、D2河原崎君、M2石川さん、西田君、M1小川君、立野君という布陣で今年度を迎えています。
グループの研究テーマについては、継続して行っているASK3をはじめとする浸透圧応答性分子の解析、細胞競合を担う分子メカニズムの解析、シングルセル解析等を用いた酸化ストレス依存的細胞死の解析があります。
浸透圧ストレス応答については、興味深いことに、浸透圧応答に関与するタンパク質が多様な病態と関連することが近年相次いで報告されています。我々が報告したASK3が制御するWNK1というキナーゼはASK3同様浸透圧で活性変化しますが、この遺伝子の変異は腎臓のイオン輸送の破綻を介して家族性高血圧症を引き起こします。 この他にも高浸透圧、低浸透圧に応答する分子の変異や欠損が炎症、免疫、神経活動、細胞分化などに関与することが次々と報告され、生体が浸透圧応答を利用して様々な生体機能を調節していることが想定されます。我々が見出したASK3などを手がかりに渡邊グループとも協力して行っている浸透圧の受容・応答に関する新たな分子メカニズムを明らかにできれば、これまで原因が不明であったり、治療が難しかった疾患の治療に役立てられるのではないかと考えています。
細胞競合(2015年度参照)については、新学術領域「細胞競合」(http://cell-competition.com/)の中での議論や交流も経験し、新しい領域の面白さと大変さについて身をもって感じながら研究を進めています。新しい現象の理解には新しい解析方法の構築なども必要になり、知れば知るほど不思議なことも現れて、発想力が試されます。研究の新領域を切り開いた先人達の凄さを感じながら、自分たちも新学術というチーム研究の力も借りて、新しい発見を目指して楽しみながら着実に頑張ろうと思っています。
シングルセル解析(2015年度参照)については、対象としている酸化ストレスに対する細胞死の解析の中で面白い現象が見えてきています。同じディッシュ上で同じ酸化ストレスを付加された細胞群の死に方が大きく2通りに分かれる様子が観察されました。まだ、この違いの理由などは解析中ですが、細胞の何らかの個性が死に方を変えていると考えられます。この細胞にとっての運命の分かれ道を説明するために、それぞれの細胞の死に方に関与する分子メカニズムの解析と、1細胞の中で生きたままシグナル伝達分子の活性変化を経時的に測定できる方法を用いた解析を行っています。これまで、細胞集団の平均値としてアウトプットを見てきた研究では見つけられなかった新しい知見が得られるものと期待しています。
このように、グループ内でさえグループに分かれているように見えますが、実はあるテーマに関与すると思っていた分子が別のテーマにひょっこり顔を出すことも結構あり、ある意味分子生物学の世界の“狭さ”も感じて驚いたりしています。もともと、我々の体の中という世界で起こることを研究しているので、どこかでつながるのは当たり前なのかも知れませんが、この関係に気づけるか、素通りするかは実験者次第ではないかと思います。複数のテーマを持つことはともすれば発散しがちになりますが、それぞれの目的をしっかりと意識し、その上で互いの相乗効果を発揮できるような研究を進めていきたいと考えています。
2015年度版
また2年まとめての紹介になります…
前年度、2014年度は4年生の新人として石川さん、西田君の2人が名黒グループに入ってきてくれました。2013年度はちょうど博士を修了する学生がおらず、さらに修士を修了した椎崎くん、丹羽君は博士課程へ進学したので、純粋に2人増え、とうとう名黒グループの人員は2桁に達しました。この人数になると切り盛りも大変ではないかと危惧しましたが、博士課程の学生も多いため新人の研究指導を任せることができ、彼らのお陰もありなんとかうまく回転しています。2014年度は、グループ初の6年制学生として芝本さんがしっかり研究もした上で卒業していき、ゲノムワイドsiRNAスクリーニングトップランナーの渡邊君が博士課程を修了しました。渡邊君は2年前の服部君のように研究室に残り、メンバーとして丹羽君を連れて新しいグループを発足させました(渡邊グループ参照)。ゲノムワイドsiRNAスクリーニングのエキスパートが2人グループを脱出してしまいましたが、ASK3に焦点を当てるという共通点もあるので、グループ間で協力しながら研究を進めて行きたいと思っています。
そして、2015年度ですが、今年度の新人は4年生の小川君、布施君が名黒グループの新人として入り、本間グループに入る同じく4年生の木田君が期間限定(6月まで)で実験手技を習いにきていたので、新人3人増になっています。正式なメンバー構成はD3神山さん、D2椎崎君、D1河原崎君、M2花房君、町田君、M1石川さん、西田君、4年小川君、布施君の9人です。院生の筆頭が初の女性ということで、例年には無い何かが起こるのではと期待しています。
グループの研究テーマについては、これまで中心に据えてきたASK3の解析ももちろん進めているのですが、人数も多くなってきたこともあり、いくつか新しい領域にも挑戦しています。それらは、1. がん転移、2. 細胞競合、3. シングルセル解析というキーワードで表されます。
1. がん転移については、前回のグループ紹介の最後のところで触れていますが、ASK1のノックアウトマウスでは血中に導入されたがん細胞の生着が極端に悪いという知見をもとに進めてきました。その結果、がん転移に関与するホスト側の血球系細胞、血管内皮細胞など様々な細胞のうち、どこでASK1ががん転移の制御に働いているか明らかになりつつあります。また、キナーゼであるASK1がどのような基質をリン酸化することでがん転移に関与するかも明らかにできれば、がん転移制御の新たな分子メカニズムに辿り着く可能性もあり、がん治療の新しいターゲットになるかもしれません。
実はこのプロジェクトではASK1ノックアウトマウスを観察していくうちに、がん転移とは別の興味深い表現型も見付かってきており、多角的な目で個体を観察することの大切さを知るよい機会にもなりました。
2. 細胞競合については、昨年度から一條研が新学術領域「細胞競合」(http://cell-competition.com/)の計画研究班として参画していることと関連があります。細胞競合とは、異なる2種類の細胞が共存した場合、選択的に一方が排除され、一方が生き残る現象を指しますが、近年の研究から発生の過程や、変異を起こしたがん細胞の排除という状況で働くことが報告されています。異なる複数の細胞が相互作用して初めて起こる面白い現象なのですが、細胞がどうやって互いの違いを感知するのか?感知した後、一方が排除される間に双方の細胞でどのようなやりとりがあるのか?これらのことについて、分子レベルのメカニズムはほとんど明らかにされていません。
うちのグループではこの問題に対し、得意のゲノムワイドsiRNAスクリーニングの手法を用いて網羅的に細胞競合に関与する遺伝子を同定し、それを手がかりに細胞競合を担うシグナル伝達分子の挙動を明らかにしようとしています。新学術というチーム研究により、領域代表の藤田先生をはじめ様々な研究者と知り合い、議論することができ、非常に勉強になっています。
3. 細胞は生命の最小単位という考え方があります。これは多細胞生物も1つの細胞から発生すること、個々の細胞が代謝、刺激への応答、成長、増殖をするなどが根拠になると思います。“シングルセル解析”とはこの最小単位である“1つ1つの”細胞の挙動と運命にフォーカスして解析することです。培養細胞を使った実験が当たり前の現在、一見そんなものは誰でもやっているように思えます。しかし、実は、一般的な解析技術の多くは細胞を解析対象にしていても、検出しているのはある時点で平均化した“細胞集団”のアウトプットになります。
例えば、イムノブロットでタンパク質の変化を見たり、LDHアッセイで細胞死を検出したりする場合、イムノブロットはそこにいた細胞集団を全て溶解してタンパク質を取り出しますし、LDHアッセイは細胞集団がいた培地を取って活性を測ります。集団にいた細胞全てが寸分違わず同じ応答と運命を辿るのであれば、得られたデータを細胞の数で割れば個々の細胞の応答といえるかもしれません。しかし、各細胞に個性があり、挙動が量的、時間的に異なる場合にはその解釈は間違いということになります。そもそもLDHアッセイで『70%の細胞が死んだ』という結果自体が、同じ状況で死んだ細胞と、死ななかった細胞がいたという細胞の個性を示しています。死んだ細胞と死ななかった細胞の運命を分けたものは何だったのでしょうか?上に例示した解析方法ではこの細胞にとっての運命の分かれ道を説明するデータを得ることはできません。集団のデータでは無く、一つ一つの細胞を観察して得られる個別のデータが因果関係の説明に必要です。
現在、この目的のために、1細胞の中で、生きたままシグナル伝達分子(特にMAPK)の活性変化を経時的に測定できる方法を導入し、刺激に対する時間経過(反応パターン)をモニターすると同時に、その細胞の運命(死ぬか死なないかなど)を見届ける実験系を構築しているところです。現在の薬は、ある機能分子を単純に活性化または阻害して病状を改善しますが、1細胞の運命をその細胞の反応パターンに基づいて記述・予想できるようになり、(まだ難しいかもしれませんが)そのパターンを人為的に調節できるようになれば、『細胞の応答パターンを調節することで病気を治療する』という新しい方法論に繋がるのではと考えています。昨今、シングルセル解析ではゲノムの個性やmRNA発現の個性からそれぞれの細胞応答の違いを説明する分野が発達してきましたが、我々は、シグナル伝達を扱ってきた者として、シグナル伝達のパターンの個性と細胞の運命をリンクさせていきたいと考えています。
今まで行ってきたASK3の解析についても、高浸透圧で形成されるASK3顆粒という面白い構造に含まれる因子の同定や、ASK3ノックアウトマウスを使った急性炎症モデルへの関与の解析などを行っています。また、ASK3と同様に浸透圧ストレス応答で働くNFAT5という転写因子がどのように浸透圧ストレスで制御されているか、ASK3の制御機構と比較しながら解析を行い、細胞の浸透圧ストレスに対するセンシングメカニズムについて明らかにしたいと考えています。このあたりは、渡邊グループも浸透圧ストレスでのASK3の制御と役割の解析を精力的に進めていますので、知見を共有して効率的な研究の進展を目指しています。
グループ内の研究内容が多岐に渡り始めましたが、生体のストレス応答を分子レベルで解き明かすという点では一貫しています。また、それぞれのプロジェクトを担当する院生達も主体的にモティベーション高く自分の研究を行ってくれていますし、互いのプロジェクトにも興味を持って議論できています。私自身も彼らと共に、一様な集団ではない、個性ある個々の集まりが達成できる研究というものを楽しみながら、高いレベルのスタンダードを保ってしっかりと研究を進めていきたいと思っています。
2013年度版
前年も更新しないままになってしまいました。今回も2年ぶりのグループ紹介になってしまっています。
2011度は武田先生、西頭先生がそれぞれ教授として栄転され、一條研の構成も大きく変わった年でした。この年度は生粋(4年生から)の名黒グループの学生としは、初めて丸山(順一)君が博士課程の修了を迎えました。本人もそうでしょうが、グループヘッドとしても感慨はひとしおです。
そして2012年度を迎え、グループの新人としては、武田グループにいたM2の神山さん、新M1に丹羽君、新4年生に古谷君が入ってきました。古谷君は大学サークルの後輩になるのですが、とうとう干支が一回りしている事実に気付き、愕然としました。この年度はやはり、これまで一條研を支えてこられた武田先生、西頭先生が不在ということで、様々な不安もありましたが、グループ員、教室員の協力でなんとかうまく切り盛りされていたと思っています。2012年度も生粋の博士第2号として服部君が課程修了を迎えました。この年度はとうとうASK3の論文をpublish出来たことがとても嬉しい印象としてあります(Nat. Commun., 2012; 3: 1285)。また、私事でも結婚したり、講師に昇任したりとイベント盛りだくさんの年でした。
さて、やっと今年度の話に入ります。名黒グループも発足以来9年目に入りました。メンバーはD2渡邊(謙吾)君、D1神山さん、M2椎崎君、丹羽君、M1河原崎君、芝本さん、4年花房君、町田君という8人構成です。昨年度博士を修了した服部君が、石川君と古谷君と一緒に新たなグループとして独立したのと、関根グループからいまだ大型新人の河原崎君、藤澤グループから6年制の芝本さんが入り、野球の得意な(多分実験も)新4年生2人が入ったという動きになりました。
研究テーマとして中心にあるものは、これまでも取り組んできているASK3という独自に同定したキナーゼを介する細胞のストレス応答機構の解析になります。前年度に出した論文では、(I) ASK3は浸透圧の変化(浸透圧ストレス)に対して独特のパターンでキナーゼ活性を変化させること、(II) ASK3の制御する細胞内シグナル伝達が、腎臓で血圧の制御に働くWNK-SPAK/OSR1経路を制御していること、(III) ASK3ノックアウトマウスが高食塩食負荷時に高血圧症を発症しやすくなることを報告しました(図1)。
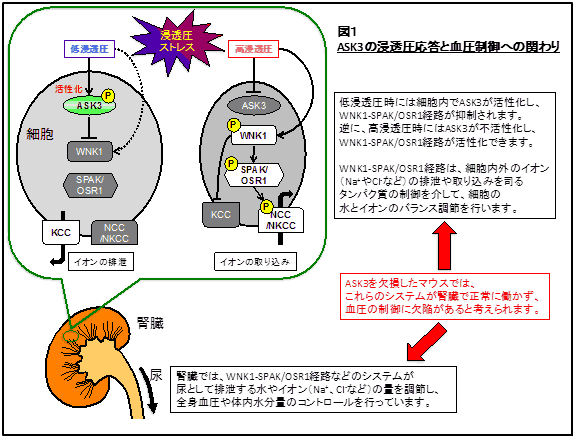
このことは、ASK3という特殊なキナーゼが体の血圧の恒常性を保つために、浸透圧に応じて働いていることを示唆しており、ASK3の解析により、体の血圧制御の新たなメカニズムが明らかになるかもしれません。
“浸透圧に応じて”と書きましたが、ASK3の浸透圧ストレスに対する応答性は他の分子にはあまり見られない独自のものです。以前にも書いたように、ASK3は細胞の周囲が低浸透圧になればなるほど活性化し、高浸透圧になればなるほど不活性化するという連続的で、かつ両方向性の活性変化を示します。応答の早さも1-2分で変化する素早いもので、可逆的であることから、ASK3は細胞が周囲の浸透圧変化を測るための浸透圧メーターのような働きをしていると考えられます。また、ASK3は『浸透圧という物理的な量』を『キナーゼ活性によるリン酸化反応の程度』という細胞内の化学的な反応に変換する変換機として働いていると見ることもできます。生体のストレス応答とは、生存に適した状態から環境がシフトした場合に、それに対応して適応しようとする動きです。その際、『シフトの方向と程度を測り、それに応じたアウトプットを出力する』ことが必須項目であり、まさにASK3は浸透圧ストレス応答において適した性質を持つ分子だと考えられます。
さて、ここで、ASK3の浸透圧に依存する独特の活性変化がどのようにして引き起こされているかという疑問が浮かびます。実は、そもそもヒトの細胞自体が浸透圧をどうやって感知しているかについて未だ不明な点が多く残されています。この問題について、私たちはASK3の活性変化を指標にしてアプローチしようと考えています。ASK3はそれ自身の活性がリン酸化により制御されているため、浸透圧依存的にASK3のリン酸化を制御する分子が存在すると考えられます(図2)。
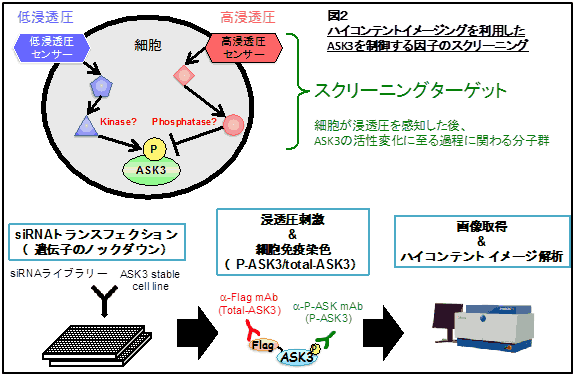
このようなシグナル伝達経路をどんどん上に遡っていくと、最初に浸透圧変化を感知する“浸透圧センサー分子”に辿り着きます。この浸透圧ストレスの際にASK3の上流で働くタンパク質分子を網羅的に同定するためにゲノムワイドsiRNAスクリーニングに取り組んでいます。技術的な詳細は2009年度に記述してありますが、簡単に言うと、ヒトがもつ全ての遺伝子を一つ一つノックダウンして失わせたときに、浸透圧依存的なASK3活性変化が起こらなくなる遺伝子を同定するというものです。既に高浸透圧ストレスに対するスクリーニングは完了し、得られた分子について解析を行っています。また、間もなく低浸透圧ストレスの方もスクリーニングを開始する予定です。
この他にも、ASK3が関わるシグナル伝達経路の解明のために、分子特異的クロスリンク法という独創的なケミカルバイオロジーを利用したASK3結合分子の探索と解析や、ASK3ノックアウトマウスを用いて、in vivoレベルでの水・イオンバランスの恒常性維持にASK3が関与するかなどに関する解析も行っています。最近、高食塩食が高血圧を引き起こすだけでなく、免疫細胞の活性化を介して自己免疫疾患の程度を悪化させるという論文なども報告されており、浸透圧やイオンバランスの維持が慢性疾患をはじめとする様々な病態の理解に重要であると考えられます。私たちのASK3を一つの手がかりとして生体の浸透圧ストレス応答機構を解明しようとする研究は、このような病態の理解や新たな治療法の確立に貢献する可能性を秘めていると思っています。また、2011年度に書いたように、個人的には浸透圧ストレスだけでなく、温度ストレスやメカノストレスなど両方向性に変化する刺激に対して、生体がどのように応答するかについても興味があり、今後さらに解析を進めていきたいと思っています。
名黒グループには、昨年度、今年度とグループの再編に伴い、他のグループから新たに参加した大学院生もおり、彼らの持つ知識や技術を活かしたテーマも行っています。具体的には、がん転移におけるASKファミリーの役割の解析や、センチュウを利用したシグナル伝達経路の遺伝学的解析です。 がん転移の研究について少し触れると、このテーマは、ASK1ノックアウトマウスでは、体外から血中に導入されたがん細胞の生着が極端に悪いという知見からスタートしています。がん細胞が生着するためにASK1の何らかの働きが必要であることを示唆する結果ですが、個体の中のどの細胞のどのような機能が重要であるかについて現在細かく解析を行っています。また、他のASKファミリー分子がASK1と同様の働きをするかについても解析を行っています。周知のとおり、がんは今や日本人の死因のトップを占める病気であり、治療が難しい理由の一つとして、がんが転移により様々な部位に拡散してしまうことがあげられます。私たちの研究により、がん転移に重要なステップが明らかになれば、それをターゲットにした治療法が開発できるかもしれません。
名黒グループも9年目になり、私自身もアラフォーに手がかかる歳に達しました。それに見合うだけの働きと、存在感を持たなければと思う今日この頃です。しかし、研究生活のなかで、新しい人、新しい技術、新しい実験データが与えてくれるインパクトを見ていると、変に落ち着いてはダメで、いつも新しいものを求める気持ちを持ち続けようと思います。毎日得られる新しいことを周りの人達、グループ員と共有しながら研究生活を進めていきたいと思っています。
2011年度版
またもや、昨年度版を出さないまま、2011年度を迎えてしまいました。ごめんなさい。
昨年度も池田君という非常にインパクトの強い4年生が入ってくれたり、うちのグループ最後の女性(?)小出さんが卒業してしまったりと、やはりいろいろありました。また、個人的には夏の2ヶ月間、シンガポールに短期留学をさせてもらい、日本ではできない多くの経験と、仲間たちを得ることができ充実した一年でした。
さて、今年度の名黒グループのメンバーはD3 丸山(順一)君、D2 服部君、D1 清水君、M2 渡邊(謙吾)君、新4年生 石川君、椎崎君(男二人)という布陣で、とうとう男だらけのグループになってしまいました。他のグループでは女性が半分を越えているところもあり、由々しき問題だと思っているところですが、仕方が無い。新4年生の男二人も6月時点で既にグループ内で独自のアイデンティティーを獲得しつつあり、この一年は男くさく頑張るつもりです。 グループの研究テーマとしては、引き続きASK3というリン酸化酵素のストレス応答を中心として行っています(詳細は前々年度以前を参照)が、ASK3と関連するストレスとして、これまでの浸透圧ストレスに加え、メカノストレス、温度ストレスという別の新たな切り口からのアプローチも開始しました。 メカノストレスに関しては私自身の昨年度のシンガポール留学におけるテーマでもありました。そもそもの発端は、浸透圧ストレスに非常に興味深い応答するASK3が一体どのようにして浸透圧変化という物理現象を感知しているか?という疑問であり、浸透圧変化に伴う細胞体積変化に注目したことです。2007年度版にもありますが、私自身は正常状態から両方向に変化しうるストレス、浸透圧、温度、pHなどの“両方向性のストレス”に対する生物の応答機構に興味を持って研究を行っています。浸透圧ストレスによる体積変化でも細胞が“伸びる”と“縮む”という両方向性の物理的な変化が起こり、メカノストレスを細胞が感じると考えられます。実際、留学中の実験により細胞に伸ばす方向のメカノストレスを与えると、低浸透圧ストレス(体積膨張)と同様にASK3が活性化するという結果を得ました。縮める方向のストレスでの解析など、より詳しい実験が必要ですが、この結果はASK3が浸透圧ストレスに応答する過程で、ストレスを細胞の体積変化という形で感知している可能性を示唆しています。
近年、メカノストレスは筋肉や骨の発達のみならず、がんの悪性化、ES細胞の分化方向決定など様々な生命現象に深く関わっていることが明らかになりつつあり、盛んに研究されている分野でもあります。これまでにメカノストレスに対する応答では、アクチン、ミオシン、チュブリンなどをはじめとした細胞骨格系タンパクや、細胞の外界との接着点である接着斑(focal adhesion)などに局在するタンパクの関与が数多く報告されています。しかし、これまでの研究でASK3の浸透圧依存的な活性変化はこれらの分子の働きを必要とせず、ある程度独立して起きている現象らしいという結果を得ており、新たなメカノストレス応答のシステムに含まれている可能性があります。今後、細胞膜や膜タンパクとの相互作用などを検討しつつ、ASK3がどのような状況のメカノストレスで働くか研究していきたいと考えています。
温度ストレスもまた両方向性のストレスの代表例であり、温度に対するASK3の応答を検討したところ、浸透圧ストレスの場合と同様に温度が下がれば活性化、上がれば不活性化と両方向性の応答を示すことが明らかになりました。恒温動物は体温を一定に保つ能力を保持しており、そのシステムはまず自らや周辺の温度を感知することからスタートするはずです。両方向の温度変化に対して両方向性に活性を変化させるASK3はこのようなシステムの制御に適しており、重要な働きをしている可能性があります。ASK3ノックアウトマウスとWTマウスのトランスクリプトーム(mRNA発現)の解析から、ASK3ノックアウトマウスで発現が変化している遺伝子の中に個体のエネルギー代謝に関わるものがいくつか検出されました。これらの知見から、今後ASK3が個体のエネルギー代謝や体温調節に関与する可能性を検討したいと考えています。また、どのようにして温度変化がASK3の活性変化につながるかについても興味深い研究課題です。
このようにASK3はこれまでに行ってきている浸透圧ストレスだけでなく、メカノストレス、温度ストレスなど様々な物理的ストレスに応答することが明らかになってきています。それぞれのストレスに対するASK3の応答メカニズムを解明し、その共通性、相違点を比較検討することでASK3という分子がどのように細胞内で物理化学的ストレスを感知しているか明らかにしたいと考えています。また、それぞれのストレスを感知したASK3がどのような生理応答を引き起こし、個体のストレス応答に寄与しているかについて、ASK3ノックアウトマウスの解析などから検討していきたいと思っています。
ともすれば、研究とはなにやら難しい世界の話と捉えがちですが、浸透圧、温度、物理的な刺激などは自分たちの周りにいくらでもあるありふれた日常の両方向性のストレスであり、誰でも知らず知らずに応答し適応しているものです。毎日自分の手のひらの上で起こっているような、身近で且つ大切な生命現象の源を解き明かしていくこと自体がとても面白いことだと思います。また同時に、そのような身近な生命現象の不調や破綻が、実は様々な病態の原因に関わっているのではないかと考え、研究を行っています。
2009年度版
2009年度になり、とうとう名黒グループも5年目になりました。
今年はずっとグループ最年長でやってくれていた梅田君が新グループとして新4年生の渡邊君とともに“ひっそりと出芽”してしまいましたが、ASK3関連のテーマを扱うということでまだまだ頼りにしています。うちのグループに新4年生は入りませんでしたが、10月からJosefinさんというスウェーデン出身のかわいい留学生が参加してくれました。時折デンマーク人のChristopher君とスウェーデン語(らしき)言葉で内緒話をしていますが、とても気さくでやる気のある学生です。うちのグループの英語の鍛錬にも役立ってくれています。
その他のメンバーは昨年から変わらず、D1 丸山君、M2 橋本君、服部君、M1 小出さん、清水君という布陣で研究を行っています。相変わらず賑やかです。
グループの研究テーマとしてはASK3というリン酸化酵素についての研究を継続しています(詳細は前年度以前を参照)。ASK3は低浸透圧に対して活性化、高浸透圧に対して不活性化するという非常に面白い“両方向性の”キナーゼ活性の変化を示しますが、この独特の浸透圧ストレスに対する活性変化がどのような分子メカニズムにより達成されているかについては全く分かっていません。私たちの研究からASK3に結合するチロシンキナーゼやASK3を脱リン酸化するフォスファターゼが明らかになり、これらによるASK3の活性制御機構を現在解明しようとしているところです。
また、ASK3活性制御メカニズムを担う分子群を網羅的に同定するために今年からひとつ新しい技術を導入しました。High-Content Analysis(HCA)技術と呼ばれる大規模なスクリーニングなどを行うためのスループットに優れたシステムです。今回導入したのは薬学部の共通機器室に設置されたThermofisher社のArrayScan VTIという画像解析機器で、この機械は細胞一つ一つの情報を数千から数万個という単位で短時間に集めることができます。この技術のすごさを説明するために、例えば私たちがASK3の解析で行ってきたリン酸化抗体を利用したキナーゼ活性の測定について、これまでのウェスタンブロットと比較してみます。
ウェスタンブロットの場合、数十万個の細胞を溶かし、タンパク溶液にした上で分離、解析を行います。この場合結果は抗体で認識される1本のバンドになる訳ですが、この“量”(今の場合キナーゼ活性)は数十万個の細胞の平均値になります。膨大な数の細胞の平均値なので統計量としては信頼性のある値ですが、その平均値の周りにどれだけばらついた状態で個々の細胞が“量”を持っていたかの情報は失われています。
一方で同じリン酸化抗体を用いて細胞免疫染色を行うと、個々の細胞を独立させた状態でひとつひとつから“量”の情報が得られます。これを数十万個の細胞について行い、平均すれば先ほどのウェスタンブロットの場合と原理的には同じ結果が得られるはずです。しかも個々の“量”の情報があるため、平均値だけでなくばらつきの指標である分散を算出することも可能です。分散が明らかになるということは、その実験系の妥当性、有効性についてより細かい視点で検証することができることを意味しており、その情報はさらなる実験の洗練の材料とすることができます。また、測定対象のデータがサンプルに混在する複数の群(例えば、細胞分裂期の細胞と休止期の細胞など)で大きく異なっていた場合、それらを分けて解析すべきであることに気づくことができるのも、個々の細胞を解析対象にしてはじめて可能なことです。
ただ、これまでは細胞免疫染色画像からこの数十万という数を解析することが現実的に無理でした。蛍光顕微鏡で個々の細胞について人がピントを合わせて測定し、次の細胞にいくなどということをすると時間がいくらあっても足りません。この部分を機械が細胞を見分け、サンプル中にある全ての細胞について即座に解析を行うことができるようにしているのがArrayScanという機器です。これがHCAたる所以です。
もう一つの所以が、細胞培養を行う96穴プレートなどに対して、機械が位置を把握し、自動で様々なウェルから好きな数のデータを測定できるというものです。つまり96枚の任意のプレパラートの好きな位置を高速で特定し、そこから画像を取得できるようなものです。この技術によりRNAiスクリーニングなど非常に多種類の処置を別々のウェルに行った上で、それらに対して同じ解析を再現よく、客観的に行うことができます。
このようなすごい機器を利用して、ASK3の浸透圧依存的な活性変化を指標に全ゲノムスケール(∼18000遺伝子)のsiRNAスクリーニングを、ヒト由来細胞を対象に行うプロジェクトを開始しています。どのような遺伝子産物がASK3の活性制御を担うものとして同定されるのか、楽しみにしています。
この他にもASK3が何のために浸透圧ストレスに応答するのか?についてASK3の担うシグナル伝達も解析しています。浸透圧ストレス時に起こる遺伝子発現変化がASK3の欠損によってどのように変化するかDNAマイクロアレイによる解析や、結合分子として得られたWNKファミリーに対する制御の解析、さらには浸透圧ストレス時の細胞体積制御に重要なチャネルに対する制御の解析など様々な視点からASK3の役割を検討しています。
最近私たちが作製したASK3ノックアウトマウスは高血圧傾向を示すことが分かり、ASK3が血圧制御に関与する可能性が明らかになりました。この知見は浸透圧ストレス応答と血圧制御の関連について新たなモデルを示す手がかりになるかもしれないと考えています。
先に触れたHCAなどの新しい技術や方法論が開発されるに従って、生物を学問として解明していくやり方もどんどん増えていきます。もちろんこれらの技術を貪欲に取り入れて研究を進めていきたいと思います。ただ、それでもやはり技術革新に頼りきるのではなく、自分たちの頭からひらめく新しいアイディアも武器として、さらに生き物を読み解いていく研究を進めていきたいと考えています。
2007年度版
2006年度版はただいま作成中という状態のまま、2007年度になってしまいました。すみません。昨年度も永田くんと丸山君というでかい二人が入ったり、河野君が修士を取得して卒業したりといろいろあったのですが、、、
開き直って2007年度版のグループ紹介をします。
名黒グループも3年目に入り、メンバーも少し増えて6人になりました。初めての博士課程(梅田君 D1)、修士課程(高木さんM2、丸山君 M1)、4年生(橋本君、服部君)とバリエーションに富んだ人員ですが、平均するとうちのグループの中で一番若い。一応グループヘッドも20代最後の年。ということでまだまだ発展途上ですが、勢い(内側で燃やす系です。【注】丸山君は外も)だけは負けないぞ!というグループです。
グループの研究テーマとしては、研究室自体のテーマであるストレス応答に関与する細胞内シグナル伝達の解析のうち、ASK3という新しく同定したリン酸化酵素の制御と生理的役割の解析を行っています。これまでの解析でこの分子は物理化学的ストレスの一つである浸透圧により非常に面白い活性変化を示すことが分かってきています。高浸透圧と低浸透圧で異なる変化を示すのです。
物理化学的ストレスには、紫外線、重力、活性酸素、浸透圧、温度など様々ありますが、これらのうち浸透圧、温度、pHなどは生き物にとって至適条件のある量です。つまり浸透圧なら約300 mOsm/kg H2Oという正常な値があり、それを上回っても下回っても生体にとってストレスになります。これらのストレスに対しては上がれば下げて、下がれば上げてという両方向性の制御があって初めて正常に保てることになります。
名黒グループではASK3というストレス変化の方向性依存的に異なる応答を示す分子を独特な切り口として、浸透圧のような両方向性の制御を必要とする量の細胞レベルでの受容と応答のメカニズムについて解明していきたいと考えています。そして、それは個体レベルでのストレス応答を理解する上で大きな手がかりになると考えています。
例えば、飲水や過剰な食塩摂取により個体レベルで水やイオン、つまりは浸透圧の恒常性が乱れた場合、うまくストレス応答ができないと体には浮腫や血圧の変化が起こります。血圧は上がりすぎても下がりすぎても病気であり、正常範囲におさめるメカニズムが生体には存在します。それが生命の最小単位である細胞に存在するタンパク質によって担われていると考えられるわけですが、浸透圧変化に応答して活性を変えるASK3はこのようなメカニズムを担うタンパク質の一つではないかと考え解析しているところです。このようにストレス応答に関わる分子の役割を解析することで、高血圧など様々な疾患に対する薬剤の新たなターゲット(分子、メカニズム)を提供できるのではないかと考えています。
具体的な研究内容
- ASK3活性制御の分子基盤の解析
- ASK3の担う細胞内シグナル伝達経路の解析
- 個体レベルでのASK3の役割の解析
1)浸透圧変化によるASK3の活性変化がどのような分子基盤により達成されているかについて、ASK3自身の分子構造の観点、活性を制御する結合分子のスクリーニング、さらにはショウジョウバエのRNAiスクリーニング系を用いた遺伝学的手法により解析しています。分子構造の解析ではASK3の独特な活性変化に必要な部分をキメラ分子の作成などにより同定することで、活性制御の構造的基盤が明らかになるものと考えています。結合分子による制御についても様々なスクリーニングの結果数多くの結合分子が見つかり、今後の解析が楽しみです。また、遺伝学的解析は結合分子の探索より広く関連する分子を探索できる手法として、系が順調に立ち上がりつつあります。これらの解析によりASK3がどのようにして浸透圧変化を感受し、リン酸化活性に変換しているか明らかにしていきたいと考えています。
2)ASK3が担う細胞内のリン酸化シグナル伝達経路についてもいろいろと分かってきています。結合分子として得られてきた遺伝性高血圧の原因分子がASK3のリン酸化による制御を受けていそうだということが分かり、現在このシグナル伝達経路に注目して解析しています。先に書いたようにASK3が実際に個体レベルの血圧制御に関与している可能性もあるのではないかと考えています。また、多くのストレスで活性化されるMAPKの一つが浸透圧ストレスにおいてASK3の下流にあることも明らかになり、この意義についてもイオンの輸送や遺伝子発現などの観点から解析を行っています。
3)分子や細胞レベルの解析によるASK3の知見を個体レベルにおけるASK3の役割に還元するため、各組織での発現分布の解析、発現臓器に由来するcell lineの利用、ASK3ノックアウトマウスの作成なども行っています。現在、もうすぐノックアウトマウスが誕生するという段階まできており、生まれるのを心待ちにしている状態です。このノックアウトマウスの解析などによりASK3が生体のどのような機能に重要な役割を果たしているか、病態との関連などはあるのかについて明らかにできるものと考えています。
この他にも、タンパク質の解析に欠かせないモノクローナル抗体の作成も行っています。良質な抗体は実験の幅を広げてくれる大切なツールであり、それを自作できることは強力な武器だと考えています。実際に当教室で使用しているASK3の抗体はグループ内で作成したとても良いものです。現在も解析したい分子の抗体やリン酸化特異的抗体の作成などをどんどん進めており、モノクロ抗体作成のノウハウは業者にも劣らないものと自負しています。
名黒グループができてASK3の解析を始めた頃に比べると様々な点が明らかになってきており、この分子の機能や役割について仮説(妄想ともいう)を膨らませる楽しさも倍増してきました。また、一つの疑問に答えが出ると、新たな謎が現れるという繰り返しでもあるので、グループメンバーはみんな忙しく実験しています。思いついた一つ一つの仮説を実験によって肯定、もしくは否定(こちらのほうが難しい)して、妄想を事実に近づけていくために日々研究を行っています。
2005年度版
名黒サブグループ
名黒サブグループは2005年4月に名黒 功(なぐろ いさお)が細胞情報学教室の助手として就任するに当たり発足したグループです。
構成としては名黒、河野(M1)、高木(4年)の3人でちいさなグループですが、とりあえず若さ(主に河野、高木。名黒には無い)を武器にがんばっていこうというグループです。
私、名黒は学生時代、現在の細胞情報学の前身である薬効安全性学教室という薬理学の研究室でカルシウムチャネルの電気生理を中心に学んでいました。博士課程に在籍中、現在の一條教授の細胞情報学教室に教室が変わり、細胞生物学という新たな領域にふれる機会がありました。この生理学、病理学的視点を色濃く持つ薬理学の教室と、分子レベルの生化学を扱うことのできる細胞生物学の教室、両方を経験できたことは自分にとってとても大きなものだったと考えています。薬学の一つの目的である基礎研究の医療への還元は、個体の病気の症状や病態を正しく把握し、それを分子レベルまで分解して理解することで初めて薬という形を取ると考えられます。その課程で大切な病態を把握する生理学的知識と、現象を分子レベルまで分解する生化学的知識の両端に触れられた経験を生かしていきたいと考えています。つまり、うちのグループでは生理学、薬理学的視点を活用しながら分子レベルまでの解析を用いて生体機構、病理機構を解明する研究を行っていきたいと思っています。
現在、当グループの研究テーマは、新たに発見したあるリン酸化酵素の解析を中心に据えて行っています。この分子に関してはまだまだ未知の部分が多く、やりたいことがいっぱいあります。
その最たるもので現在取り組んでいるのがこの分子のノックアウトマウス作成です。これまでに、このリン酸化酵素が腎臓に多く発現し、ストレスの一つである浸透圧の変化によって活性を変化させることが分かりました。親グループである松沢グループにも書いてありますが、細胞内の分子の現象を個体レベルの表現系と関連づけて考えるために大きな助けとなるのが、ノックアウトマウスの解析です。ノックアウトマウスができればこのリン酸化酵素の生理的役割や病態への関与について明らかになっていくはずです。
リン酸化酵素の役割の理解には、活性化状態と不活性化状態を単に行き来する分子という認識だけでなく、その分子がいつ(活性化刺激、発達段階)、どこで(組織、細胞内局在)、どれくらい(活性化程度と持続時間)活性化するかという知見が大切です。これらを把握することは生命現象を一度分解して得た一つの分子の働きを個体の生理反応に正しく再構成するうえで必須です。そのため、従来当研究室で洗練、蓄積されてきたタンパクを扱う手法に加えて、細かい時間、空間分解能を持つ共焦点レーザー顕微鏡などの手法も用いてこの分子の性質の解析を行っています。
さらに、この分子の基質および活性を制御する分子の同定を目的に、浸透圧依存的(リン酸化活性依存的)に結合する分子の探索も行っています。このような分子の同定から、このリン酸化酵素が担うシグナル伝達経路がどのような生理応答に関与するか、その位置づけが明らかになると期待されます。
名黒グループの研究はまだ始まったばかりでどのように発展していくか未知な部分も多いですが、だからこそいろいろな驚きと感動を経験できると考えて日々の研究を行っています。
名黒グループの研究内容について興味のある方、またはこのページに対してのご意見やご感想は以下のメールアドレスにお気軽にメールしてください。
nagurois@mol.f.u-tokyo.ac.jp