メンバー
渡邊謙吾(特任助教),井上雅斗(M2),高柳早希(M2),森下和浩(M1)
過去メンバー
丹羽國祥(D2〜特任研究員 → H29就職),周翔宇(M1〜D1 → H30より山内グループ・現D2),塩田光司(B4〜M2 → H29就職), Siobhán Hellberg(短期留学生 → H28帰国)
グループ概要
―私達のグループは,今年より新しく名黒グループからひっそりと発足しました―(2009年度 梅田グループ紹介文より引用)
本グループヘッドの渡邊が一條研の門を叩いたのは2009年.名黒グループから発足したばかりの梅田グループに唯一のグループ員として所属することになりました.1年後,師匠の卒業に伴い,名黒グループへと異動.5年間名黒グループにて研究に従事した後の2015年,師匠同様,名黒グループからひっそりと(?)本グループを発足させました.今年度で発足4年目に突入しましたが,発足当初からのグループ員であった丹羽君,周君,塩田君が一斉にグループを去り,発足時の規模に縮小したことから,また初心に戻って「とりあえず若さ(主に森下君.渡邊には無い)を武器にがんばっていこう」(2005年度 名黒グループ紹介文より改変)と思っている次第です.
研究概要
本グループは,哺乳類細胞における浸透圧ストレスの認識から応答に至る分子機構の全貌解明を主目的として研究しています.大まかな戦略としては,ASK3を解析の中心に据え,①細胞はどのように両方向性のストレス変化を認識しているのか,②細胞はどのように両方向性のストレス応答を誘導しているのか,③細胞は浸透圧ストレス応答システムを他の細胞機能においても利用しているのか,といった3つの柱について各研究プロジェクトを並行して推進しています.
研究背景
生体の構成単位である細胞は,半透膜の性質を有する細胞膜によってその内外を隔て,生命活動の場を規定しています.細胞内外はイオンや糖,アミノ酸などを含む水溶液であり,その濃度が常に変動することから,細胞は恒常的に浸透圧ストレスを受けています.具体的には,細胞外液の浸透圧が細胞内液の浸透圧よりも高くなった場合(=高浸透圧ストレス),細胞内の水分子が強制的に細胞外へと流出し,細胞は収縮させられてしまいます.逆に細胞外液の浸透圧が細胞内液の浸透圧よりも低くなった場合(=低浸透圧ストレス),細胞は膨張させられます.このような体積変化は細胞内の緻密な化学反応ネットワークを乱して正常な生命活動を妨げるものであり,細胞は直ちにイオン濃度を調節して細胞体積を元に戻そうとします.一方,細胞内イオン濃度の変化は細胞内物質の安定性に影響を与えてしまうため,長期的には,細胞は糖やアミノ酸などの生成量を調節し,それらをイオンと置き換えることで浸透圧ストレスに適応します.このような細胞の浸透圧ストレス応答研究の歴史は長く,イオン輸送を担うイオンチャネルやイオントランスポーターに関する知見は多く得られています.しかし,細胞がいかに浸透圧ストレスを認識し,これらイオン輸送分子を制御しているのかについては未だ不明です.確かに,脂肪酸やGタンパク質,カルシウムイオン, MAPK【図1】,Tyrキナーゼなど,浸透圧ストレス応答に関与する分子については多くの報告があります【参考1&2】.ただ,細胞は体積がどの程度変化したのかという強度だけでなく,膨らんだのか縮んだのかという方向性も認識可能な普遍的なシステムを有すると想定されるにも関わらず,これまでの多くの研究は方向性に関する視点が欠けており,根本的な細胞内システムの解明には至っていませんでした. 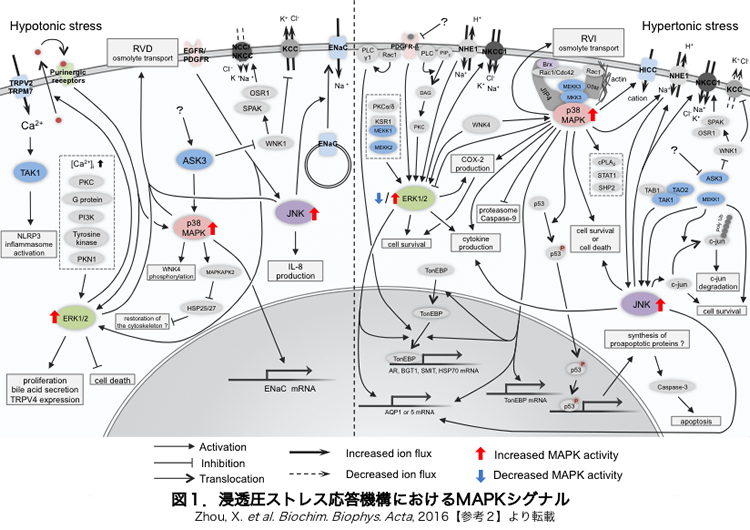
以前当研究室では,ASK3(HGNC Gene Symbol: MAP3K15)というSer/Thrキナーゼが生体の血圧制御に重要であることを報告しました【参考3】.その際,ASK3が低浸透圧ストレスでリン酸化され活性化するのに対し,逆に高浸透圧ストレスでは脱リン酸化され不活性化することも見出しました.つまりASK3は,方向性のある浸透圧ストレスに対して方向性を反映した応答を示すことを意味しており,細胞が浸透圧ストレスを認識して応答する上で非常に適した分子だと予想されました.そして最近,予想通り,ASK3が低浸透圧ストレスと高浸透圧ストレスのいずれの状況においても細胞体積の回復を制御していることを実証しました【参考4】.従ってASK3は,浸透圧ストレスの認識から応答に至る分子機構を理解する上で足掛かりになる分子だと考えられます.
研究内容①―浸透圧ストレスの認識機構
浸透圧は基本的な現象にも関わらず,そもそも哺乳類細胞が浸透圧ストレスを認識する分子機構でさえ不明な点が多い状況です.ASK3はその活性変化が刺激後数分という迅速さ,数十mOsmという鋭敏さ,連続的な変化に対する可逆性といった特徴を有するため【参考3】,浸透圧ストレス応答機構において比較的上流に位置すると推察されます.つまり,浸透圧ス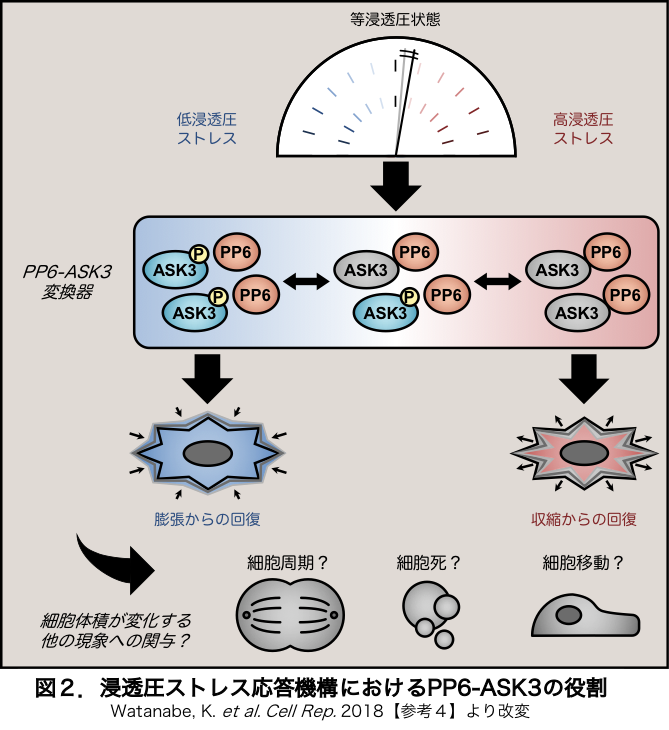 トレスにおけるASK3の活性制御機構を解明することが,早い段階の細胞の浸透圧ストレス認識機構の解明に直結すると考えられます.しかし,これまで精力的に解析されてきたASK1の活性制御機構とは対象的に【参考5】,ASK3の活性制御機構については完全に未解明でした.そこで我々は,より一般に浸透圧ストレスを認識するセンサー分子の同定も視野に入れながら,浸透圧ストレスにおけるASK3活性制御分子を同定する目的で,ヒトの全遺伝子に対してRNA干渉法を用いた網羅的な探索(ゲノムワイドsiRNAスクリーニング)を行いました.その結果,多くの興味深い候補分子を得ることに成功しましたが,本当に大変なのはここからで,得られた候補分子がどのようにASK3の活性制御に関わるのか解明すべく,ゴリゴリ解析を進めなければなりません.これまでに,ASK3不活性化制御分子としてPP6というプロテインホスファターゼの同定に成功し,PP6は高浸透圧ストレス下でASK3と結合し,直接ASK3を不活性化することを明らかにしました【参考4】.これはまさに,浸透圧ストレスの強度と方向性の情報がPP6とASK3の結合変化を介してASK3の活性変化に変換されていることを意味し,これまで不明だった根本的な細胞内システムの1つを解明したことになります【図2】.ただ,解明できたのは一部分に過ぎず,全貌解明を目指して,他の候補分子の解析も引き続き進めています.
トレスにおけるASK3の活性制御機構を解明することが,早い段階の細胞の浸透圧ストレス認識機構の解明に直結すると考えられます.しかし,これまで精力的に解析されてきたASK1の活性制御機構とは対象的に【参考5】,ASK3の活性制御機構については完全に未解明でした.そこで我々は,より一般に浸透圧ストレスを認識するセンサー分子の同定も視野に入れながら,浸透圧ストレスにおけるASK3活性制御分子を同定する目的で,ヒトの全遺伝子に対してRNA干渉法を用いた網羅的な探索(ゲノムワイドsiRNAスクリーニング)を行いました.その結果,多くの興味深い候補分子を得ることに成功しましたが,本当に大変なのはここからで,得られた候補分子がどのようにASK3の活性制御に関わるのか解明すべく,ゴリゴリ解析を進めなければなりません.これまでに,ASK3不活性化制御分子としてPP6というプロテインホスファターゼの同定に成功し,PP6は高浸透圧ストレス下でASK3と結合し,直接ASK3を不活性化することを明らかにしました【参考4】.これはまさに,浸透圧ストレスの強度と方向性の情報がPP6とASK3の結合変化を介してASK3の活性変化に変換されていることを意味し,これまで不明だった根本的な細胞内システムの1つを解明したことになります【図2】.ただ,解明できたのは一部分に過ぎず,全貌解明を目指して,他の候補分子の解析も引き続き進めています.
研究内容②―浸透圧ストレス応答の誘導機構
浸透圧ストレスの初期応答として,細胞は細胞内外のイオン輸送を制御して,強制的に変化させられた細胞体積を回復します.中でもVRACと呼ばれるアニオンチャネルは,低浸透圧ストレス後の細胞膨張からの体積回復(regulatory volume decrease: RVD)における重要性が薬理学・電気生理学的研究によって示されていましたが,長らくその分子実体が不明でした.近年遂にゲノムワイドsiRNAスクリーニングによって分子実体が同定され,活性調節機構など,今後の詳細な機能解析が期待されている“ホットな”分子です【参考6】.他にもNKCCs やKCCs,NHEsといったイオントランスポーターなどが,浸透圧ストレス後の体積回復機構においてエフェクター分子として知られています.
一方ASK3は,NKCCsやKCCsを直接のリン酸化で制御するWNK-SAPK/OSR1経路を制御したり,VRACやNHEsを制御すると言われるp38 MAPKを制御したりすることが明らかになってきました【参考3&7】.そこで,これらエフェクター分子へのASK3の関与を検証することで,ASK3を起点とする浸透圧ストレス応答の誘導機構の体系的な理解に迫りたいと考えています.
New【追記】VRACの分子実体として同定された“ホットな”分子LRRC8Aの構造解析プロジェクト(東大・院理・濡木研究室)に参画するご縁があり,我々は得られた構造に基づく変異体の機能解析を担当しました【参考13】.本成果はLRRC8Aの制御機構について原子分解能レベルでの知見を与える重要なものであり,今後はこの知見を活かしつつ,分子間レベルでの制御機構を上記のASK3を起点とする検証によって明らかにすることで,体系的な理解に迫りたいと考えています.
研究内容③―浸透圧ストレス応答と他の細胞機能との関連可能性
細胞体積は根本的な細胞の構成要素であるため,細胞体積が変化する他の細胞機能においても,細胞は浸透圧ストレス応答システムを利用している可能性が提唱されてきました【参考1&図2】.しかし,細胞体積変化を担うエフェクター分子の関与が示されているに過ぎず,本当にシステムとして共通モジュール化しているのか不明です.一方我々は,浸透圧ストレス応答機構における重要分子ASK3とその上流制御分子を見出しており,これまでよりも踏み込んだレベルで検証が可能な状況にあることから,浸透圧応答システム自体と他の生理機能の関連性についても積極的に解析しています.例えば,アポトーシスにおいて細胞が収縮することはよく知られていますが,その際,細胞はVRACを利用して積極的に体積を収縮していることが示唆されています.一方,ASK1は"apoptosis signal-regulating kinase 1"と名付けられて以来【参考8】,アポトーシスにおける役割が研究されてきただけでなく,最近ではアポトーシス以外の細胞死における役割も明らかになってきています【参考9】.よって,細胞体積制御の点で,ASKファミリーが浸透圧ストレス応答と細胞死を関連させていると想定して検証を進めています.
萌芽研究―組織特異的ASK1結合分子の解析
これまで当研究室ではASKファミリーに対して酵母ツーハイブリッド法やプルダウン・質量分析法といった一般的な結合分子探索によって多くの成果を得てきました【代表例:参考3,10&11】.また,他の研究グループからもASKファミリーを対象としたプルダウン・質量分析法が行われるなど【参考12】,ASKファミリーの結合分子は同定され尽くしたように思われるかもしれません.しかし,ASKファミリーはそれぞれ特徴的な組織発現分布を示すため,各組織で構成されるASKシグナロソームも異なることが容易に推測されます.そこで当研究室では, ASK1の遺伝子改変マウスを作製し,そのマウス由来の初代培養細胞を用いたケミカルプルダウン法を確立することで,組織特異的な内在性ASK1結合分子の同定を試みてきました.その結果,既存の結合分子以外に新規結合分子の同定に成功し,現在解析を進めています.
本研究プロジェクトは,今年度よりグループに加わった高柳さんが元々服部グループで行っていたプロジェクトであり,上記の浸透圧ストレス応答研究プロジェクトとは主目的・性質が大きく異なります.しかし,解析対象とする細胞機能には共通する部分が存在するため,互いの関連性を意識しながら進めることで相乗効果が生まれ,ASKファミリーを基準とした体系的な理解に繋がると考えています.
社会的意義・今後の期待
以上,一見薬学というよりも基礎的な生物学に近い研究内容ではありますが,加齢や高食塩食の摂取に伴いASK3を持たないマウスがより重度な高血圧症状を示すことは【参考3】,ASK3の活性制御機構の異常によっても高血圧になる可能性があり,本研究は新規の高血圧治療戦略に繋がることが期待されます.また上記の通り,細胞分裂や細胞死,細胞移動など細胞体積が変化する現象においても,細胞は浸透圧ストレス応答システムを利用している可能性が近年提唱されています.よって,本研究成果によって明らかになる分子機構を基に細胞体積を積極的に操作することで,炎症やがんなど様々な疾患に対する新規治療戦略の開発に発展する可能性も秘めており,目先ばかりに囚われず,常に最終的な意義について柔軟に想像・意識しながら,日々研究に取り組んでいます.
参 考
1.Else K. Hoffmann, Ian H. Lambert and Stine F. Pedersen. Physiology of Cell Volume Regulation in Vertebrates. Physiol. Rev. 89, 193–277 (2009).
2.Xiangyu Zhou, Isao Naguro, Hidenori Ichijo and Kengo Watanabe. Mitogen-activated protein kinases as key players in osmotic stress signaling. Biochim. Biophys. Acta 1860, 2037–2052 (2016).
3.Isao Naguro, Tsuyoshi Umeda, Yumie Kobayashi, Junichi Maruyama, Kazuki Hattori, Yutaka Shimizu, Keiichiro Kataoka, Shokei Kim-Mitsuyama, Shinichi Uchida, Alain Vandewalle, Takuya Noguchi, Hideki Nishitoh, Atsushi Matsuzawa, Kohsuke Takeda and Hidenori Ichijo. ASK3 responds to osmotic stress and regulates blood pressure by suppressing WNK1-SAPK/OSR1 signaling in the kidney. Nat. Commun. 3, 1285 (2012).
4.Kengo Watanabe, Tsuyoshi Umeda, Kuniyoshi Niwa, Isao Naguro and Hidenori Ichijo. A PP6-ASK3 Module Coordinates the Bidirectional Cell Volume Regulation under Osmotic Stress. Cell Rep. 22, 2809–2817 (2018).【本論文は掲載号の表紙を飾りました.図3】
5.Takuto Nishida, Kazuki Hattori and Kengo Watanabe. The regulatory and signaling mechanisms of the ASK family. Adv. Biol. Regul. 66, 2–22 (2017).
6.Thomas J. Jentsch. VRACs and other ion channels and transporters in the regulation of cell volume and beyond. Nat. Rev. Mol. Cell Biol. 17, 293–307 (2016).
7.Junichi Maruyama, Yumie Kobayashi, Tsuyoshi Umeda, Alain Vandewalle, Kohsuke Takeda, Hidenori Ichijo and Isao Naguro. Osmotic stress induces the phosphorylation of WNK4 Ser575 via the p38MAPK-MK pathway. Sci. Rep. 6, 18710 (2016).
8.Hidenori Ichijo, Eisuke Nishida, Kenji Irie, Peter ten Dijke, Masao Saitoh, Tetsuo Moriguchi, Minoru Takagi, Kunihiro Matsumoto, Kohei Miyazono and Yukiko Gotoh. Induction of Apoptosis by ASK1, a Mammalian MAPKKK That Activates SAPK/JNK and p38 Signaling Pathways. Science 275, 90–94 (1997).
9.Kazuki Hattori, Hiroyuki Ishikawa, Chihiro Sakauchi, Saki Takayanagi, Isao Naguro and Hidenori Ichijo. Cold stress-induced ferroptosis involves the ASK1-p38 pathway. EMBO Rep. 18, 2067–2078 (2017).
10.Masao Saitoh, Hideki Nishitoh, Makiko Fujii, Kohsuke Takeda, Kei Tobiume, Yasuhiro Sawada, Masahiro Kawabata, Kohei Miyazono and Hidenori Ichijo. Mammalian thioredoxin is a direct inhibitor of apoptosis signal-regulating kinase (ASK) 1. EMBO J. 17, 2596–2606 (1998).
11.Hiroaki Nagai, Takuya Noguchi, Kengo Homma, Kazumi Katagiri, Kohsuke Takeda, Atsushi Matsuzawa, and Hidenori Ichijo. Ubiquitin-like Sequence in ASK1 Plays Critical Roles in the Recognition and Stabilization by USP9X and Oxidative Stress-Induced Cell Death. Mol. Cell 36, 805–818 (2009).
12.Joel D. Federspiel, Simona G. Codreanu, Amy M. Palubinsky, Ama J. Winland, Carlos Morales Betanzos, BethAnn McLaughlin and Daniel C. Liebler. Assembly Dynamics and Stoichiometry of the Apoptosis Signal-regulating Kinase (ASK) Signalosome in Response to Electrophile Stress. Mol. Cell. Proteomics 15, 1947–1961 (2016).
New13.Go Kasuya, Takanori Nakane, Takeshi Yokoyama, Yanyan Jia, Masato Inoue, Kengo Watanabe, Ryoki Nakamura, Tomohiro Nishizawa, Tsukasa Kusakizako, Akihisa Tsutsumi, Haruaki Yanagisawa, Naoshi Dohmae, Motoyuki Hattori, Hidenori Ichijo, Zhiqiang Yan, Masahide Kikkawa, Mikako Shirouzu, Ryuichiro Ishitani, Osamu Nureki. Cryo-EM structure of the volume-regulated anion channel LRRC8. bioRxiv [PREPRINT] 331207, (2018).