����O���[�v 2012
���O���[�v�����o�[
�@�@�@�����(�y����)�A�Ћˈ��(D3)�A���c����(D2)
�������T�v
�@����O���[�v�́A���A����2008�N���ɕč����w����A�����ă��j���[�A���X�^�[�g���܂����B����ɍ��N���炱��܂ł̌����W�����A�ێR�ƍr���V�O���[�v�Ƃ��ēƗ����Ă��܂�(�ێR�T�u�O���[�v�̃y�[�W���Q�Ƃ��ĉ�����)�B���̗��w��́A�J���t�H���j�A��w�T���f�B�G�S�Z��Michael Karin�������ŁA�L�i�[�[�V�O�i�������̂̍\�����q�̓���Ƃ��̊������䃁�J�j�Y������Ȍ����e�[�}�ł���1-4)�B�ŋ߁A�L�i�[�[�Ɍ��炸�A�V�O�i���֘A���q�͊�{�I�Ɍ݂��ɑ傫�ȕ����̂��`�����A���̒��Ŕ����Ȓ��߂��s���邱�ƂŁA���l�ȃV�O�i���������\�ƂȂ邱�Ƃ��������Ă��܂����B�{�������̃e�[�}�ł���ASK1�ɂ��Ă����l�ŁA�Q���h�ߏ�ł͔��ɑ傫�ȕ����̂��`�����Ă��܂�5)�B�����̕����̂̍\�����q�̓���Ƌ@�\��͂��AASK1���q�̏㗬�����̃V�O�i������@�\�Ɛ����@�\���𖾂���ł��d�v�ȏ��ƂȂ�ƍl���Ă���܂��B���̃L�i�[�[�̕��q���x���ł̊��������J�j�Y���ɂ��Ă͗��w�ȑO����̃e�[�}�ł�����6)�A���������������͂��s���Ă��������Ǝv���Ă��܂��B
�@����ASK1���啡���̂���X��ASK1�V�O�i���\�[���ƌĂ�ł��܂��B��̓I��ASK1�V�O�i���\�[���ɂ́AASK1�������j�Q���q�ł���`�I���h�L�V���Ȃǎ_���X�g���X�Z���T�[���q��AASK1���������q�ł���A�_�v�^�[���qTRAF2�y��TRAF6�Ȃǂ̃��r�L�`�����֘A���q���܂܂�Ă��邱�Ƃ��������Ă��܂�5) [�}1]�B���ہAASK1�̒E���r�L�`�����y�fUSP9X���_���X�g���X�ˑ��I��ASK1�ƌ������A�������ˑ��I��ASK1�̃��r�L�`�����ɂ�镪����}�����邱�ƂŁAASK1�̎����I�������ƃA�|�g�[�V�X�U���Ɋ֗^���邱�Ƃ����N�A�������ł͖��炩�ɂ��Ă��܂�7)�B�������w���ɁA�ʂ�MAP3K�ł���MEKK1�̃L�i�[�[�V�O�i�������̂̍\�����q�ɂ́A���l��TRAF�A�_�v�^�[���q��r�L�`�����y�f���܂܂�Ă���A����炪MEKK1�̊�������ɒ��S�I�Ȗ������ʂ����Ă��邱�Ƃ����o���܂����B���̂悤�ɃV�O�i�������̂̍\�����q�̓���Ƌ@�\��͂̓V�O�i�����q�̐����@�\�̗����ɏd�v�ł��B���ۂ�ASK1�V�O�i���\�[���ɂ͏�L�ȊO�ɂ��l�X�ȕ��q���܂܂�Ă��邱�Ƃ��������Ă���A���݁A�_���X�g���X�Z���T�[���q�ɂ��Ă��Ћ����A���r�L�`�����֘A���q�̉�͂��ێR���r�������ꂼ��S�����ĉ�͂�i�߂Ă���܂�(�{�v���W�F�N�g�ɂ��Ă��ێR�O���[�v�̃y�[�W���Q��)�BASK�t�@�~���[��ASK2��ASK1�V�O�i���\�[���\�����q�ł���AASK1�݉��ł̓v���e�A�\�[���V�X�e������ĕ����������Ƀ��j�[�N�ȕ��q�ł��邱�Ƃ��������Ă���8)�A���̕����̐����I�Ӌ`�ɂ��ẮA���N�̐V�l���]�����������s���Ă��܂��B
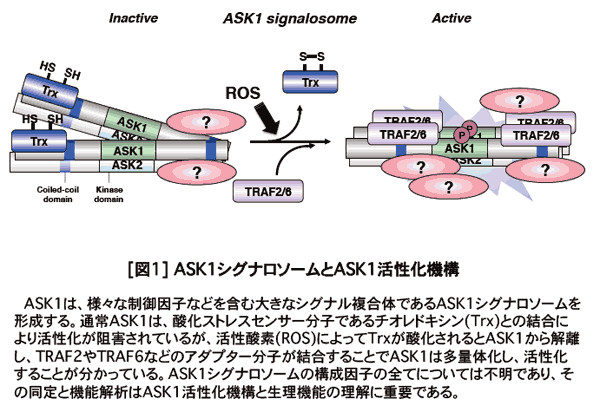
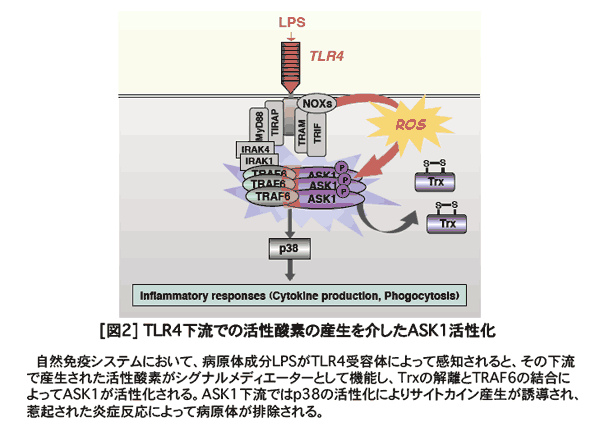
�@�{�������ł̗��w�ȑO�̐��ʂŁAASK1�m�b�N�A�E�g�}�E�X�̉�͂ɂ��AASK1��TLR4��e�̉����ŃV�O�i�����f�B�G�[�^�[�Ƃ��Ă̊����_�f����Ď��R�Ɖu�����ɕK�{�ł��邱�Ƃ����o���Ă���܂�9) [�}2]�B���̌�AASK1�͔��їU���≊�ǔ����Ƃ������Ɖu�����≊�ǔ������[���ւ�錻�ۂɊ�^���Ă��邱�Ƃ����X�Ɩ��炩�ƂȂ�܂���10-12)�BASK1�́A�����_�f�̂悤�ȃ��f�B�G�[�^�[����āA�זE���݂̂łȂ��Ɖu�����ȂǕ��L�������@�\�̐���@�\�Ɋ֗^���A�X�̃X�g���X�h���ɉ��������l�Ȑ�����p�����镪�q�ł��邱�Ƃ��������Ă����킯�ł��B�����̔w�i����ɁAASK�t�@�~���[���q�̃m�b�N�A�E�g�}�E�X��p����in vivo�ł̐����@�\�A���ɉ��ǂ�Ɖu�V�X�e���Ƃ̊֘A���ɂ��Ă�������i�߂����ƍl���Ă��܂��B�{�e�[�}�ɂ����c���V���Ɏ��g��ł��܂��B
�@�@�܂����N�����[������������������u�Ő�[�E�����㌤���J���x���v���O�����v�ɍ̑�����A�u�V�O�i���̐V���ȍ쓮�����Ƃ��ُ̈�ɂ�鉊�ǥ���ȖƉu�������ǃ��J�j�Y���̉��v���v���W�F�N�g�̃e�[�}�Ƃ��Ď��g��ł��܂��B�{�e�[�}�ł́A�O�q�����V�O�i�������́A���ɖƉu��e�̂̉����Ō`�������Ɖu�V�O�i���\�[���̍\�����q��ԗ��I�ɓ��襋@�\��͂��Ă������ƂŁA�Ɖu�V�O�i���̕��q����@�\�̉𖾂Ǝ������ÕW�I���q�̔�����ڎw���Ă��܂��B�Ɖu�V�O�i���\�[���́A�a���̊����X�g���X�̊��m��Ɖu�V�O�i���̑�����ϊ��������s���A���l�ȖƉu������U������Ƌ��ɁA���̍\�����q�ł���L�i�[�[��r�L�`�����y�f�̑��ݍ�p�ɂ�镡�G�ȃV�O�i������̏�ɂ��Ȃ��Ă��܂��B���̕����̒��ł̃V�O�i���̃o�����X����ُ̈킪�l�X�ȖƉu�����̌����ƂȂ��Ă���ƍl�����A�Ɖu�V�O�i���\�[���̒��̍\�����q�襉�͂��A�V���Ȏ��ÕW�I��헪������Ƌ��ɁA�ۥ�E�C���X�����Ƃ����������w�I�X�g���X�̎�e−�����V�X�e���Ƃ��Ă̖Ɖu�@�\�q���x���ʼn𖾂������ƍl���Ă��܂��B
�@��w�����̖�w�����̖ړI�Ƃ��̓����́A�u�W�I�`�����Ɩ�p��L���镨���Ƃ̑��ݍ�p�E��p�@��q���x���ʼn𖾂����v���Ƃɂ���āA������I�Ȏ������Ö@��ڎw�����n��^�[�Q�b�g���q��T�����邱�Ƃł���A���݁A���̃^�[�Q�b�g�͌ÓT�I�Ȗ���e�̒`���͂������A���̒�����ASK1�̂悤�ȍזE�����`�B�n�̕��q�ւƁA���߂���͈͍͂L�������܂��B�͈͂�������L�����Ă��A���n�邽�߂ɁA�����ɖ{���̕W�I�⌻�ۂ𑨂��邩���d�v�ł��邱�Ƃɂ͕ς��͂���܂���B�č����w���Ɋ��������Ƃ́A������O�̂悤�ł����A�@�����ɏ�肭�{����͂ނ��Ƃ��ł��邩�����ɑ厖�Ȗ��ŁA����͓���̃��{�ł����{���̈Ӗ��łȂ��Ȃ��̌��ł��Ȃ����Ƃ��Ǝv���܂��B����ɁA�A������ǂ��\�����邩���������炢�����̐��ۂ����E����v�f�ł��邱�Ƃ��������܂����B�����ɑ厖�Ȕ����ł��A�L�����m����c�_�̏�ɏ��Ȃ���Δ������Ă��Ȃ��̂��������ƂŁA���Ȗ����ł�������܂���B�{���̔����Ƃ����̂́A���E�̌����҂��ʂ̐l�X�ɂ��L���m��ꗘ�p�������̂ŁA�P���ɖ�ŗႦ��A���ʂ��m���ŁA�N�����g���A�ǂ�������Ƃ������ƂɂȂ�܂��B�]���āA��w��w����̌����҂����������ۂɎ��s���Ă������߂ɂ́A���ۓI�ȕ\���ł����A���n�邱�Ƃɗǂ��Ӗ��ł������×~�ł��邱�Ƃ��K�v�ł���Ɗ����Ă��܂��B
�@�Ō�ɁA�������Ƃ����ǖʂ��������āA�B�����ɏW�����Ď��ۂɖڕW��B���ł��邩�A���̗͂����邩�ۂ��Ō����e�[�}�̏������傫���ς�邱�Ƃ𗯊w�������ӎ��������܂����B�������̂悤�ɁA�č��̓T�C�G���X�̐��E�����łȂ��A�S�̂Ƃ��Ă��̂悤�ȋC�����Y���Ă��܂��B���̗͂͌����ĉ^�ł͂Ȃ��A�w�͂œ�������̂ł���A�����ҁA���Ƀ��[�_�[�Ƃ��āA���������łȂ����̃��{��O���[�v�����̑S�Ă̌����҂̐l���������肵�Ă��܂��d�v�Ȏ����ł��邱�Ƃ��������܂����B��̔������͂��߁A�T�C�G���X�ɂ�����d��Ȕ����͌��I�Ɍ���邱�Ƃ������A���R���̎Y���ł��邩�̂悤�ȍ��o�Ɋׂ��Ă��܂��܂����A�����Ď�̓͂��Ȃ����̂ł͂���܂���B�n��ɂ͂����������R�̗v�f�͊܂܂�Ă��Ȃ��͂��ŁA���T�C�G���X�ł̑傫�Ȕ����́A�m���Ȍ������ʂƂ��̕��Ր��A�����҂̎����\�͂Ɋ�Â����̂��Ǝv���Ă��܂��B
������
1) *Matsuzawa, A., *Tseng, P. H., Vallabhapurapu, S., Luo, J. L., Zhang, W., Wang, H., Vignali, D. A., Gallagher, E., Karin, M. Essential Cytoplasmic Translocation of a Cytokine Receptor-Assembled Signaling Complex. Science [Research Article], 321, 663-668 (2008).
2) *Tseng, P. H., *Matsuzawa, A., Zhang, W., Mino, T., Vignali, D. A., Karin, M. Different modes of TRAF3 ubiquitination selectively activate type I interferon and proinflammatory cytokine expression. Nat. Immunol., 11, 70-75 (2010).
3) *Vallabhapurapu, S., *Matsuzawa, A., Zhang, W., Tseng, P. H., Keats, J. J., Wang, H., Vignali, D. A., Bergsagel, P. L., Karin, M. Nonredundant and complementary functions of TRAF2 and TRAF3 in a ubiquitination cascade that activates NIK-dependent alternative NF-kB signaling. Nat. Immunol., 9, 364-370 (2008).
4) *Gallagher, E., *Enzler, T., *Matsuzawa, A., Anzelon-Mills, A., Otero, D., Holzer, R., Janssen, E., Gao, M., Karin, M. Kinase MEKK1 is required for CD40-dependent activation of the kinases Jnk and p38, germinal center formation, B cell proliferation and antibody production. Nat. Immunol., 8, 57-63 (2007).
5) Noguchi, T., Takeda, K., Matsuzawa, A., Saegusa, K., Nakano, H., Gohda, J., Inoue, J.I., Ichijo, H. Recruitment of TRAF family proteins to the ASK1 signalosome is essential for oxidative stress-induced cell death. J. Biol. Chem., 280, 37033-37040 (2005).
6) Fujino, G., Noguchi, T., Matsuzawa, A., Yamauchi, S., Saitoh, M., Takeda, K., Ichijo, H. Thioredoxin and TRAF family proteins regulate reactive oxygen species-dependent activation of ASK1 through reciprocal modulation of the N-terminal homophilic interaction of ASK1. Mol. Cell. Biol., 27, 8152-8163 (2007).
7) Nagai, H., Noguchi, T., Homma, K., Katagiri, K., Takeda, K., Matsuzawa, A., Ichijo, H. Ubiquitin-like sequence in ASK1 plays critical roles in the recognition and stabilization by USP9X and oxidative stress-induced cell death. Mol. Cell, 36, 805-818 (2009).
8) Takeda, K., Shimozono, R., Noguchi, T., Umeda, T., Morimoto, Y., Naguro, I., Tobiume, K., Saitoh, M., Matsuzawa, A., Ichijo, H. Apoptosis signal-regulating kinase (ASK) 2 functions as a mitogen-activated protein kinase kinase kinase in a heteromeric complex with ASK1. J. Biol. Chem., 282, 7522-7531 (2007).
9) *Matsuzawa, A., *Saegusa, K., Noguchi, T., Sadamitsu, C., Nishitoh, H., Nagai, S., Koyasu, S., Matsumoto, K., Takeda, K., Ichijo H. ROS-deepndent activation of TRAF6-ASK1-p38 pathway is selectively required for TLR4-mediated innate immunity. Nat. Immunol., 6, 587-592 (2005).
10) Osaka, N., Takahashi, T., Murakami, S., Matsuzawa, A., Noguchi, T., Fujiwara, T., Aburatani, H., Moriyama, K., Takeda, K., Ichijo, H. ASK1-dependent recruitment and activation of macrophages induce hair growth in skin wounds. J. Cell Biol., 176, 903-909 (2007).
11) Noguchi, T., Ishii, K., Fukutomi, H., Naguro, I., Matsuzawa, A., Takeda, K., Ichijo H. Requirement of reactive oxygen species-dependent activation of ASK1-p38 MAPK pathway for extracellular ATP-induced apoptosis in macrophage. J. Biol. Chem., 283, 7657-7665 (2008).
12) Iriyama, T., Takeda, K., Nakamura, H., Morimoto, Y., Kuroiwa, T., Mizukami, J., Umeda, T., Noguchi, T., Naguro, I., Nishitoh, H., Saegusa, K., Tobiume, K., Homma, T., Shimada, Y., Tsuda, H., Aiko, S., Imoto, I., Inazawa, J., Chida, K., Kamei, Y., Kozuma, S., Taketani, Y., Matsuzawa, A., Ichijo, H. ASK1 and ASK2 differentially regulate the counteracting roles of apoptosis and inflammation in tumorigenesis. EMBO J., 28, 843-853 (2009).
* These authors contributed equally to this work. |