�֍��i����j�O���[�v�@2013
�q�����o�[�r
�@
�@���� �֍��i����j�j�D
�@D2 �R���ޔ��q
�@D1 ���ۗY�S
�@M2 �����t�q
�@M1 ���������
�@B4 �X�R���
�@��w�@�O���l���w���@�@���_���j
�q�O���[�v�T�v�r
�֍��i����j�O���[�v�́A2011�N4�����A���������ŏy�������Ƃ߂Ă����܂������c�O�����m�i���E�F�����w��w�@�㎕�������ȍזE����w����E�����j�̃O���[�v���甭�����܂����B���̌�A�O���[�v�̓������o�āA���݁A�����W�l�̃����o�[�Ŋ������Ă��܂��B
�q�����v���W�F�N�g�r
�@�֍��i����j�O���[�v�̃L�[���[�h���u�X�g���X�����v�u�~�g�R���h���A�v�u�זE���v�ł��B
�������̃O���[�v�ł́A PGAM5�ASARM ����� KLHDC10 �Ƃ���3 �̃X�g���X�������q�̉�͂��s�Ȃ��Ă��܂��B
�@�@ �~�g�R���h���A�Ǎ݃X�g���X�������q�̉�́iPGAM5�ASARM�j
�@�~�g�R���h���A�� ATP �Y���ɂ��G�l���M�[�����̏�Ƃ��Ă݂̂Ȃ炸�A�זE����E�C���X���������ȂǗl�X�ȃX�g���X�����V�O�i���̐���̏�Ƃ��Ă��d�v�ȓ�����S�����Ƃ��m���Ă��܂��B�������̃O���[�v�ł́A�X�g���X������ MAP �L�i�[�[�o�H�̍ŏ㗬�Ɉʒu���� MAPKKK �̈�AASK1 �̊��������q�Ƃ��ē��肳�ꂽ PGAM5 ����� ASK1 �̊����������q�ł���SARM �Ƃ������q���~�g�R���h���A�ɋǍ݂��邱�Ƃɒ��ڂ��A�~�g�R���h���A�Ƃ�����ł����̕��q���S���X�g���X�����̉�͂��s�Ȃ��Ă��܂��B
�@�A �_���X�g���X�ɉ�������V�K�זE��������q�̉�́iKLHDC10�j
�@ASK1 ������������ł���\�I�ȃX�g���X�Ƃ��āA�_���X�g���X������܂��B���������ɂ�����ASK1 �̊��������q�Ƃ��ē��肳��A�_���X�g���X�ˑ��I�ȍזE���𐧌䂷�邱�Ƃ����炩�ƂȂ����^���p�N�� KLHDC10 �ɂ��āA���̌̂ɂ����鐶���I�����̉�͂��s�Ȃ��Ă��܂��B
�q�������e�r
�~�g�R���h���A�Ǎ^�v���e�C���z�X�t�@�^�[�[ PGAM5 �̉�� �i�֍��i����j�A���ہA����A���j
�@PGAM5 (Phosphoglycerate mutase family member 5) �́A���������ɂ�����ASK1 �̌������q�Ƃ��ē��肳��܂����BPGAM5 �͈ꎟ�\����̔z��̑���������́A�z�X�z�O���Z�����_���^�[�[�iPGAM�j�t�@�~���[�ɑ����܂��B���̃t�@�~���[�ɑ����镪�q�̂������͉n�ɂ����āA�z�X�z�O���Z�����_�̕��q�������_��]�ڔ����i���^�[�[�����j��S�����Ƃ��m���Ă��܂��BPGAM5 �ɂ����Ă��A���^�[�[�����ɕK�{�̍y�f�������S�̃A�~�m�_���ۑ�����Ă��܂����A���c�O�����m�̉�͂���APGAM5 �̓��^�[�[������L�����A�Z�����E�X���I�j�����ٓI�v���e�C���z�X�t�@�^�[�[������L���邱�Ƃ����炩�ƂȂ�܂����B����ɁAPGAM5 �͂��̃z�X�t�@�^�[�[�����ˑ��I�� ASK1 �����������邱�Ƃ��킩��܂����i�}�P�j�y�����P�z�BPGAM5 �̓q�X�`�W�����y�f�������S�Ƃ���v���e�C���z�X�t�@�^�[�[�ł���A�����̃v���e�C���z�X�t�@�^�[�[�ɂ͗ގ����Ȃ��S���V�����^�C�v�̃v���e�C���z�X�t�@�^�[�[�ł��B���̓_�́A���ɑ傫�Ȕ����ł����B
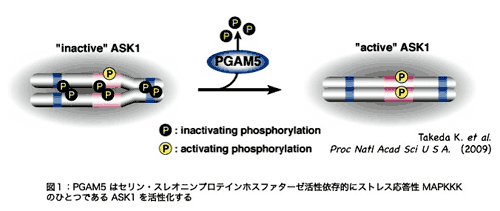
�@PGAM5 �� PGAM�t�@�~���[�ɑ����镪�q�̂Ȃ��ł��A���̍y�f�����݂̂Ȃ炸�A�זE���Ǎ݂ɂ����Ă�������L���܂��BPGAM5 �� PGAM �t�@�~���[���q�̒��ŗB�� N ���[�ɖ��ђʃh���C����L���܂��B�������́APGAM5 �����̖��ђʃh���C������āA��Ƀ~�g�R���h���A�̓����ɋǍ݂��邱�Ƃ����o���܂����B��q�����悤�� PGAM5 ���X�g���X������ MAP �L�i�[�[�o�H�����������邱�Ƃ���A�������� PGAM5 ���~�g�R���h���A�ɂ����鉽�炩�̃X�g���X�����Ɋ֗^����ƍl���APGAM5 ����������X�g���X�̒T�����s���܂����B���̌��ʁA�~�g�R���h���A�̓����d�ʂ�ቺ������ CCCP �Ƃ�����܂����u���邱�Ƃɂ��APGAM5 ���~�g�R���h���A�Ǎ^�����{�C�h�v���e�A�[�[ PARL �ɂ��A�ؒf����邱�Ƃ����o���܂����i�}�Q�j�y�����Q�z�B���̐ؒf�́APGAM5 �̖��ђʃh���C�����ŋN�����Ă���A�v���e�A�[�[���S���ؒf�̂Ȃ��ł��u�����ؒf�v�ƌĂ���ނɑ����܂��B
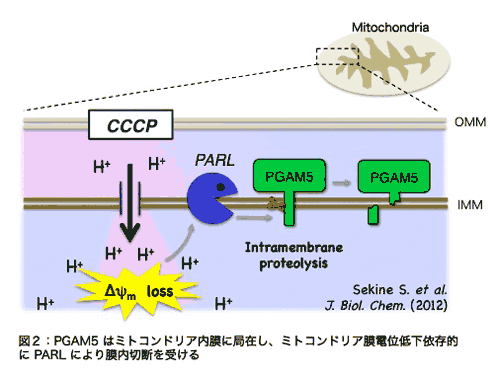
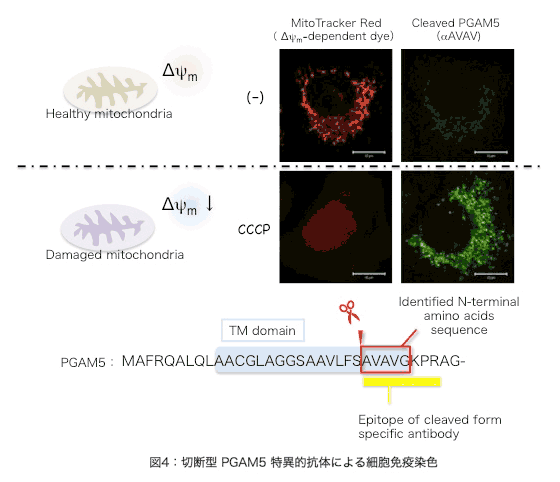
�@�ߔN�A�~�g�R���h���A���d�ʒቺ�ɔ����A�l�X�ȃ~�g�R���h���A�Ǎ݃^���p�N���̐ؒf�����䂳��邱�ƁA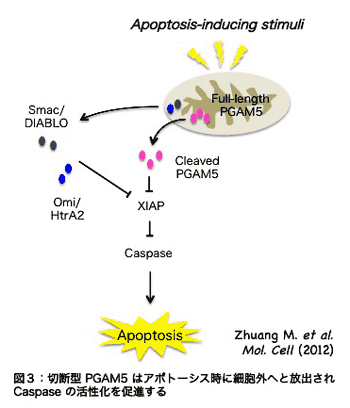 ����т��̐ؒf���䂪�~�g�R���h���A�ɂ�����X�g���X�����̃g���K�[�ƂȂ��Ă��邱�Ƃ����炩�ƂȂ��Ă��Ă��܂��B���������āAPGAM5 �̐ؒf�����炩�̃X�g���X�����Ɋ�^������̂ƍl�����܂��B�ŋ߁A���̌����O���[�v����APGAM5 ���זE���̑��i���q�ł��邱�Ƃ��������ŕ���܂����y�����R�A�S�z�B���ɁA�זE���̈�`�Ԃł���A�|�g�[�V�X�ɂ����āA�ؒf�^ PGAM5 ���~�g�R���h���A����זE���ւƕ��o����AIAP �t�@�~���[�ƌĂ��^���p�N���̊�����j�Q���邱�Ƃɂ��A�A�|�g�[�V�X�̎��s���q�ł���J�X�p�[�[�̊�������U�����āA�A�|�g�[�V�X�𑣐i���邱�Ƃ�����Ă��܂��i�}�R�j�B���̂悤�ȓ���������^���p�N���Ƃ��āASmac/DIABLO�AHtrA2/Omi ���m���Ă��܂����BPGAM5 �� N ���[�̐ؒf�z�� (AVAV) �́A�����̃^���p�N���� N ���[�ɋ��ʂ��Ď����AIAP �t�@�~���[�^���p�N���ւ̌����ɕK�v�Ȕz��ɔ��ɂ悭���Ă��܂��B�����̌��ʂ́A�ؒf�^ PGAM5 ���S���X�g���X�����̈���A�|�g�[�V�X���i�ł��邱�Ƃ��Ӗ����܂��B ����т��̐ؒf���䂪�~�g�R���h���A�ɂ�����X�g���X�����̃g���K�[�ƂȂ��Ă��邱�Ƃ����炩�ƂȂ��Ă��Ă��܂��B���������āAPGAM5 �̐ؒf�����炩�̃X�g���X�����Ɋ�^������̂ƍl�����܂��B�ŋ߁A���̌����O���[�v����APGAM5 ���זE���̑��i���q�ł��邱�Ƃ��������ŕ���܂����y�����R�A�S�z�B���ɁA�זE���̈�`�Ԃł���A�|�g�[�V�X�ɂ����āA�ؒf�^ PGAM5 ���~�g�R���h���A����זE���ւƕ��o����AIAP �t�@�~���[�ƌĂ��^���p�N���̊�����j�Q���邱�Ƃɂ��A�A�|�g�[�V�X�̎��s���q�ł���J�X�p�[�[�̊�������U�����āA�A�|�g�[�V�X�𑣐i���邱�Ƃ�����Ă��܂��i�}�R�j�B���̂悤�ȓ���������^���p�N���Ƃ��āASmac/DIABLO�AHtrA2/Omi ���m���Ă��܂����BPGAM5 �� N ���[�̐ؒf�z�� (AVAV) �́A�����̃^���p�N���� N ���[�ɋ��ʂ��Ď����AIAP �t�@�~���[�^���p�N���ւ̌����ɕK�v�Ȕz��ɔ��ɂ悭���Ă��܂��B�����̌��ʂ́A�ؒf�^ PGAM5 ���S���X�g���X�����̈���A�|�g�[�V�X���i�ł��邱�Ƃ��Ӗ����܂��B
�@���݁A�������́A�~�g�R���h���A���d�ʒቺ�ˑ��I�� PGAM5 �̖����ؒf�ɂ��āA��Ɏ��̂��Ƃɋ����������Č�����i�߂Ă��܂��B
�@�P�F�~�g�R���h���A���d�ʒቺ�Ƃ����������w�I�X�g���X�͂ǂ̂悤�ȕ��q���J�j�Y���Ŋ��m����A�v���e�A�[�[�̊�������ɂȂ����Ă���̂�
�@�Q�F PGAM5 �̐ؒf�́A�זE�E�̂ɂ����Ăǂ̂悤�Ȑ����I�Ӌ`������
�@�P�Ɋւ��ẮA�ؒf�^ PGAM5 ����ٓI�ɔF������R�̂ɂ���čזE�Ɖu���F���s���i�}�S�j�A���̃V�O�i�����ʓI�ɕ]������n���\�z���A�Q�m�����C�h siRNA �X�N���[�j���O�ɂ��㗬���q�̒T�����s�Ȃ��Ă��܂��i���ہA���j�B
�@�Q�Ɋւ��ẮAPGAM5 �m�b�N�A�E�g�}�E�X��p���āA����X�g���X�ׂ��邱�Ƃɂ���Č����\���^�̉�͂��s�Ȃ��Ă��܂��i����j�B�זE������ɂ�����V���� PGAM5 �̖������T�����ł��i�֍��i����j�j�B
TIR �h���C����L����~�g�R���h���A�Ǎ݃A�_�v�^�[�^���p�N�� SARM �̉�� �i�����j
�@C. elegans ��p������`�w�I��͂ɂ�� ASK1 �̐����I���\���O NSY-1 �̊��������q�Ƃ��āATIR-1 �����肳��Ă��܂��y�����T�z�BTIR-1 �̚M���ނɂ�����z�����O�Ƃ��āASARM �ƌĂ�镪�q�����݂��܂��BSARM �́A���R�Ɖu�����ɂ����čۂ�E�C���X��F�������e�� TLR �̉����ŁA��e�̂ƍזE���̃V�O�i���`�B���q���Ȃ��A�_�v�^�[�^���p�N�� TIR �t�@�~���[�ɑ����镪�q�̈�ł��B�������Ȃ���ATLR �V�O�i���ɂ����� SARM �̖����͑��� TIR �t�@�~���[���q�Ɣ�r����Ƃ悭�킩���Ă��Ȃ��Ƃ��낪��������܂��B���̂悤�Ȓ��A�ʔ������Ƃɍŋ߁ASARM ���~�g�R���h���A�ɋǍ݂��邱�Ƃ�����܂����y�����U�z�B�����Ŏ������́A�M���ނɂ����Ă� SARM �� ASK1 �����������邱�Ƃ��ł��邩�A����������Ƃ�����~�g�R���h���A�Ǎ݂Ƃ̊֘A�͂��邩�ۂ��A�ɋ����������Č������͂��߂܂����i�����j�B
�ߔN�ASARM �́A�������Ȋ��ł̐_�o�זE���i�_�o�ϐ��A�E�C���X�����j�Ɋ֗^���邱�Ƃ����X�ƕ���Ă���A�����I�ɂ� SARM �� ASK1 �̊���������Ă��̂悤�ȃX�g���X�����𐧌䂵�Ă�����ʔ����Ǝv���Ă��܂��B
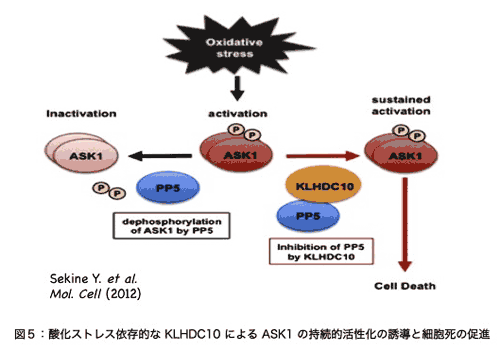
ASK1 ���������qKLHDC10 �ɂ��_���X�g���X�ˑ��I�ȍזE�������KLHDC10�m�b�N�A�E�g�}�E�X�̕\���^��� �i�R���j
�@KLHDC10 �́A���������ɂ����čs��ꂽ�V���E�W���E�o�G��p������`�w�I�X�N���[�j���O�ɂ��AASK1 �̊��������q�Ƃ��ē��肳�ꂽ���q�ł��B���̌�̉�͂ɂ��AKLHDC10 �� ASK1 �̕s���������q�ł���z�X�t�@�^�[�[ PP5 �Ɏ_���X�g���X�ˑ��I�Ɍ������A���̃z�X�t�@�^�[�[������}�����邱�Ƃɂ���� ASK1 �̎����I�Ȋ������������N�������Ƃ����炩�ƂȂ�܂����B�זE���_���X�g���X�ɔ����ƍזE�����U������܂����AKLHDC10�ɂ�� ASK1 �̊������̎������́A���̎_���X�g���X�ˑ��I�ȍזE���U���Ɋ�^���邱�Ƃ��킩��܂����i�}�T�j�y�����V�z�B���݁A�������� KLHDC10 �m�b�N�A�E�g�}�E�X���쐬���A����X�g���X���������ł̕\���^��͂��s�Ȃ��Ă��܂��i�R���j�B
�y�����z
�@�P�jTakeda, K., Komuro, Y., Hayakawa, T., Oguchi, H., Ishida, Y., Murakami, S., Noguchi, T., Kinoshita, H., Sekine, Y., Iemura, S., Natsume, T. and Ichijo, H.�@ Proc. Natl. Acad. Sci. USA. (2009)
�@�Q�jSekine, S., Kanamaru, Y., Koike, M., Nishihara, A., Okada, M., Kinoshita, H., Kamiyama, M., Maruyama, J. Uchiyama, Y., Ishihara, N., Takeda,K. and Ichijo, H.�@ J. Biol. Chem. (2012)
�@�R�jZhuang, M., Guan, S., Wang, H., Burlingame, A., and Wells, J.�@ Mol. Cell (2012)
�@�S�jWang, Z., Jiang, H., Chen, S., and Wang, X.�@ Cell (2012)
�@�T�jChuang, CF., and Bargmann, CI.�@ Genes Dev. (2005)
�@�U�jPanneerselvam, P., Singh, LP., Ho, B., Chen, J., and Ding, JL.�@ Biochem J. (2012)
�@�V�jSekine, Y., Hatanaka, R., Watanabe, T., Sono, N., Iemura, S., Natsume, T., Kuranaga, E., Miura, M., Takeda, K., and Ichijo, H.�@ Mol. Cell (2012)
�q�Ō�Ɂr
�@�����Ȋw�����̖ʔ����Ƃ���́A�����̑̂̂ǂ����̍זE�ŋN�����Ă��邱�Ƃ����ɍs�����Ƃ��ł���Ƃ��낾�Ǝv���Ă��܂��B���i�̐����ɂ����āA���X�ӂ肩�����Ă���l�X�ȃX�g���X��F���E��e���A�K�ȃX�g���X���������Ƃ�����Ă���X�g���X�������q�����̓������ӎ����邱�Ƃ͏��Ȃ���������܂��A������ʂ��āA�זE�̒��ŋN�����Ă���~�N���Ȑ��E�ɋ������芴��������A�O���[�v���݂�Ȃŋ��L�������Ǝv���Ă��܂��B�Ȃ��Ȃ��^�������o���͈̂꒩��[�ɂ͂����Ȃ����Ƃ������ł����A���X�����b�ɂȂ��Ă���ł��낤�^���p�N������Ȃ̂ŁA�����̓����ɃX�|�b�g���C�g�ĂĐ��ɑ���o����悤�A����肽���Ǝv���Ă��܂��B
|