メンバー
林 裕輝(特任研究員)、早川 怜志(M2)、萩谷 健人(M2)
研究概要
2020年度より藤澤グループから林が独立して発足した本グループでは、「異常な膜タンパク質の分解メカニズムの解明」をメインテーマに研究を行っています。膜タンパク質分解という私たちの体内の全ての細胞において必須な生命現象を分子レベルで解き明かしつつ、膜タンパク質の異常蓄積が一因と考えられている神経変性疾患など様々な疾患のメカニズム解明や治療戦略の提唱にも繋げていきたいと考えています。
研究内容詳細
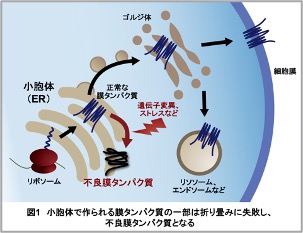 膜タンパク質は、私たちの体内のありとあらゆる細胞で細胞内外の物質のやりとりやシグナル伝達、生体物質の代謝反応など、細胞の正常な機能の維持に重要な役割を果たしています。膜タンパク質の細胞内における主要な合成の場は、小胞体(Endoplasmic reticulum: ER)という細胞内小器官です(図1)。リボソームで合成された膜タンパク質の前駆体はまず小胞体膜へと挿入され、小胞体の内外に存在するシャペロンという分子群の助けを借りながら正常な形へと折り畳まれます。正常な立体構造を獲得できた膜タンパク質は小胞体から搬出され、様々な細胞内小器官で正常タンパク質として機能します。しかし、膜タンパク質は折り畳みが難しいものが多く、一定の割合で折りたたみに失敗した不良膜タンパク質が生じます。また、膜タンパク質自体やシャペロン群をコードする遺伝子への変異、あるいは様々なストレスにより不良膜タンパク質が大量に生じやすくなります。このような不良膜タンパク質は小胞体に蓄積して小胞体ストレスと呼ばれるストレス状態を引き起こし、最終的には細胞死に繋がります。小胞体への不良膜タンパク質の蓄積は筋萎縮性側索硬化症やパーキンソン病、網膜色素変性症をはじめ多種多様な疾患においてみられ、これらの疾患発症の引き金となりうることが提唱されています。
膜タンパク質は、私たちの体内のありとあらゆる細胞で細胞内外の物質のやりとりやシグナル伝達、生体物質の代謝反応など、細胞の正常な機能の維持に重要な役割を果たしています。膜タンパク質の細胞内における主要な合成の場は、小胞体(Endoplasmic reticulum: ER)という細胞内小器官です(図1)。リボソームで合成された膜タンパク質の前駆体はまず小胞体膜へと挿入され、小胞体の内外に存在するシャペロンという分子群の助けを借りながら正常な形へと折り畳まれます。正常な立体構造を獲得できた膜タンパク質は小胞体から搬出され、様々な細胞内小器官で正常タンパク質として機能します。しかし、膜タンパク質は折り畳みが難しいものが多く、一定の割合で折りたたみに失敗した不良膜タンパク質が生じます。また、膜タンパク質自体やシャペロン群をコードする遺伝子への変異、あるいは様々なストレスにより不良膜タンパク質が大量に生じやすくなります。このような不良膜タンパク質は小胞体に蓄積して小胞体ストレスと呼ばれるストレス状態を引き起こし、最終的には細胞死に繋がります。小胞体への不良膜タンパク質の蓄積は筋萎縮性側索硬化症やパーキンソン病、網膜色素変性症をはじめ多種多様な疾患においてみられ、これらの疾患発症の引き金となりうることが提唱されています。
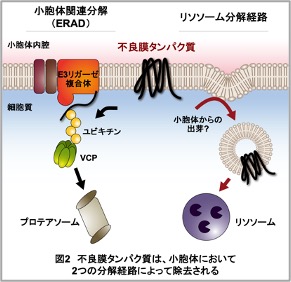 このような不良膜タンパク質の蓄積を防ぐため、小胞体には不良膜タンパク質を選択的に分解して除去するシステムが存在します(図2)。その一つが小胞体関連分解(ER-associated degradation: ERAD)と呼ばれる分解経路です。ERADにおいて不良膜タンパク質は、小胞体膜上のE3リガーゼ複合体にユビキチン化修飾を施され、VCPによって小胞体膜から引き抜かれてプロテアソームという巨大分子複合体に運ばれ、分解されます。一方で、特に凝集しやすい不良膜タンパク質はリソソームという細胞内小器官に輸送されて分解されると考えられていますが、その詳細なメカニズムは明らかになっていません。本グループでは、ほぼ未解明のリソソーム分解経路の分子メカニズムの解明を目指しつつも、ERADについてもさらに詳細な分子メカニズムを明らかにしていくことで、小胞体における不良膜タンパク質分解の全体像を解明していきたいと考えています。
このような不良膜タンパク質の蓄積を防ぐため、小胞体には不良膜タンパク質を選択的に分解して除去するシステムが存在します(図2)。その一つが小胞体関連分解(ER-associated degradation: ERAD)と呼ばれる分解経路です。ERADにおいて不良膜タンパク質は、小胞体膜上のE3リガーゼ複合体にユビキチン化修飾を施され、VCPによって小胞体膜から引き抜かれてプロテアソームという巨大分子複合体に運ばれ、分解されます。一方で、特に凝集しやすい不良膜タンパク質はリソソームという細胞内小器官に輸送されて分解されると考えられていますが、その詳細なメカニズムは明らかになっていません。本グループでは、ほぼ未解明のリソソーム分解経路の分子メカニズムの解明を目指しつつも、ERADについてもさらに詳細な分子メカニズムを明らかにしていくことで、小胞体における不良膜タンパク質分解の全体像を解明していきたいと考えています。